أفانديا لعلاج مرض السكري
اسم العلامة التجارية: AVANDIA
اسم عام: روزيجليتازون ماليات
محتويات:
مؤشرات والاستخدام
الجرعة والإدارة
أشكال الجرعة والقوة
موانع
المحاذير والإحتياطات
ردود الفعل السلبية
تفاعل الأدوية
استخدام في السكان محددة
جرعة زائدة
وصف
علم الصيدلة السريرية
علم السموم غير الإكلينيكي
الدراسات السريرية
كيف زودت
أفانديا ، روسيجليتازون ماليات ، معلومات المريض (في سهل الانجليزية)
تحذير
فشل القلب الاحتقاني ونقص تروية عضلة القلب
- الثيازوليدينيون ، بما في ذلك روسيجليتازون ، يسبب أو يؤدي إلى تفاقم قصور القلب الاحتقاني لدى بعض المرضى [انظر المحاذير والإحتياطات]. بعد بدء AVANDIA ، وبعد زيادة الجرعة ، راقب المرضى بعناية بحثًا عن علامات وأعراض قصور القلب (بما في ذلك زيادة الوزن الزائدة السريعة ، وضيق التنفس ، و / أو الوذمة). إذا تطورت هذه العلامات والأعراض ، فيجب إدارة قصور القلب وفقًا للمعايير الحالية للرعاية. علاوة على ذلك ، يجب النظر في وقف أو تخفيض جرعة AVANDIA.
- لا ينصح AVANDIA في المرضى الذين يعانون من قصور القلب أعراض. هو بطلان بدء AVANDIA في المرضى الذين يعانون من فشل القلب NYHA من الدرجة الثالثة أو الرابعة. [نرى موانع و المحاذير والإحتياطات.]
- تحليل تلوي لـ 42 دراسة سريرية (متوسط المدة 6 أشهر ؛ أظهر 14،237 مريضًا إجماليًا ، معظمهم قارنوا AVANDIA بالعلاج الوهمي ، أن AVANDIA يرتبط بزيادة خطر حدوث أحداث نقص تروية عضلة القلب مثل الذبحة الصدرية أو احتشاء عضلة القلب. ثلاث دراسات أخرى (متوسط المدة 41 شهرا ؛ 14،067 إجمالي المرضى) ، مقارنة AVANDIA ببعض العوامل المضادة للسكري عن طريق الفم أو الدواء الوهمي ، لم يؤكدوا أو يستبعدوا هذا الخطر. في مجملها ، فإن البيانات المتاحة عن خطر نقص تروية عضلة القلب ليست حاسمة. [نرى المحاذير والإحتياطات.]
أعلى
مؤشرات والاستخدام
وحيد والعلاج المختلط
يشار إلى AVANDIA كعنصر مساعد في النظام الغذائي وممارسة التمارين الرياضية لتحسين السيطرة على نسبة السكر في الدم لدى البالغين الذين يعانون من داء السكري من النوع 2.
القيود الهامة للاستخدام
- بسبب آلية عملها ، تنشط AVANDIA فقط في وجود الأنسولين الداخلي. لذلك ، لا ينبغي أن تستخدم AVANDIA في المرضى الذين يعانون من مرض السكري من النوع 1 أو لعلاج الحماض الكيتوني السكري.
- لا ينصح بالتزامن مع AVANDIA والأنسولين.
- لا ينصح باستخدام AVANDIA مع النترات.
أعلى
الجرعة والإدارة
ينبغي أن تكون إدارة العلاج المضادة لمرض السكر فردية. يجب على جميع المرضى بدء AVANDIA بأقل جرعة موصى بها. يجب أن تصحب الزيادات الإضافية في جرعة AVANDIA بمراقبة دقيقة للأحداث الضائرة المتعلقة بالاحتفاظ بالسوائل [انظر تحذير محاصر و المحاذير والإحتياطات].
يمكن إعطاء AVANDIA بجرعة تبدأ من 4 ملغ كجرعة يومية واحدة أو في جرعتين مقسومتين. للمرضى الذين يستجيبون بشكل غير كافٍ بعد 8 إلى 12 أسبوعًا من العلاج ، على النحو الذي يحدده انخفاض نسبة الجلوكوز في بلازما الصيام (FPG) ، يمكن زيادة الجرعة إلى 8 ملغ يوميًا كعلاج وحيد أو بالاشتراك مع الميتفورمين ، السلفونيل يوريا ، أو السلفونيل يوريا زائد الميتفورمين. يتم وصف التخفيضات في المعلمات نسبة السكر في الدم عن طريق الجرعة والنظام في إطار الدراسات السريرية. قد تؤخذ AVANDIA مع أو بدون الطعام.
يجب ألا تتجاوز الجرعة اليومية الكلية من AVANDIA 8 ملغ.
وحيد
جرعة البدء المعتادة من AVANDIA هي 4 ملغ تدار إما كجرعة واحدة مرة واحدة يوميًا أو في جرعات مقسمة مرتين يوميًا. في التجارب السريرية ، أسفر نظام 4 ملغ مرتين يوميًا عن أكبر انخفاض في FPG والهيموجلوبين A1c (HbA1c).
مزيج مع السلفونيل يوريا أو الميتفورمين
عند إضافة AVANDIA إلى العلاج الحالي ، يمكن استمرار الجرعة (الجرارات) الحالية للعامل (العوامل) عند بدء العلاج باستخدام AVANDIA.
السلفونيل يوريا: عند استخدامه مع السلفونيل يوريا ، فإن جرعة البداية المعتادة من AVANDIA هي 4 ملغ تدار إما كجرعة واحدة مرة واحدة يوميًا أو في جرعات مقسمة مرتين يوميًا. إذا أبلغ المرضى عن نقص السكر في الدم ، فيجب تقليل جرعة السلفونيل يوريا.
الميتفورمين: جرعة البدء المعتادة من AVANDIA بالاقتران مع الميتفورمين هي 4 ملغ إما كجرعة واحدة مرة واحدة يوميًا أو في جرعات مقسمة مرتين يوميًا. من غير المحتمل أن تتطلب جرعة الميتفورمين تعديل بسبب نقص السكر في الدم أثناء الجمع بين العلاج مع AVANDIA.
مع مزيج السلفونيل يوريا زائد الميتفورمين
يتم إعطاء جرعة البداية المعتادة من AVANDIA مع السلفونيل يوريا زائد الميتفورمين 4 ملغ إما كجرعة واحدة مرة واحدة يوميًا أو جرعات مقسمة مرتين يوميًا. إذا أبلغ المرضى عن نقص السكر في الدم ، فيجب تقليل جرعة السلفونيل يوريا.
السكان المريض محددة
القصور الكلوي: لا يلزم تعديل الجرعة عند استخدام AVANDIA كعلاج وحيد للمرضى الذين يعانون من قصور كلوي. منذ بطلان الميتفورمين في مثل هؤلاء المرضى ، هو بطلان الإدارة المصاحبة للميتفورمين و AVANDIA أيضا في المرضى الذين يعانون من القصور الكلوي.
اختلال كبدي: يجب قياس إنزيمات الكبد قبل بدء العلاج باستخدام AVANDIA. لا ينبغي بدء العلاج باستخدام AVANDIA إذا أظهر المريض أدلة سريرية على نشاطه مرض الكبد أو زيادة مستويات الترانساميناز في المصل (ALT> 2.5X الحد الأعلى الطبيعي في بداية علاج نفسي). بعد بدء AVANDIA ، يجب مراقبة أنزيمات الكبد بشكل دوري وفقًا للحكم السريري لأخصائي الرعاية الصحية. [نرى المحاذير والإحتياطات و صيدلية سريرية.]
اخصائي اطفال: البيانات غير كافية للتوصية باستخدام الأطفال من AVANDIA [انظر استخدام في فئات محددة].
أعلى
أشكال الجرعة ونقاط القوة
يحتوي قرص TILTAB المغلف بغشاء البنتاغون على روزيجليتازون باعتباره المالت على النحو التالي:
- 2 ملغ - الوردي ، debossed مع SB من جانب و 2 من جهة أخرى
- 4 ملغ - برتقالي ، مزهر مع SB من جهة و 4 من الجانب الآخر
- 8 ملغ - الأحمر والبني ، debossed مع SB من جانب و 8 من جهة أخرى
أعلى
موانع
هو بطلان بدء AVANDIA في المرضى الذين يعانون من فشل القلب المنشأة في نيويورك القلب (NYHA) من الدرجة الثالثة أو الرابعة [انظر تحذير محاصر].
أعلى
المحاذير والإحتياطات
فشل القلب
يمكن أن يتسبب مرض AVANDIA ، مثله مثل الثيوليوليدينيون ، بمفرده أو بالاشتراك مع عوامل أخرى مضادة لمرض السكر ، في احتباس السوائل ، مما قد يؤدي إلى تفاقم أو يؤدي إلى فشل القلب. يجب مراعاة المرضى للعلامات وأعراض فشل القلب إذا تطورت هذه العلامات والأعراض ، فيجب إدارة قصور القلب وفقًا للمعايير الحالية للرعاية. وعلاوة على ذلك ، يجب النظر في وقف أو تخفيض جرعة روزيجليتازون [انظر تحذير محاصر].
المرضى الذين يعانون من قصور القلب الاحتقاني (CHF) NYHA من الدرجة الأولى والثانية الذين عولجوا مع AVANDIA لديهم خطر متزايد من أحداث القلب والأوعية الدموية. وأجريت دراسة تخطيط صدى القلب لمدة 52 أسبوع ، مزدوجة التعمية ، وهمي تسيطر عليها في 224 مريضا من النوع 2 مرض السكري و NYHA Class I أو II CHF (جزء طرد - 45٪) على الخلفية لمرض السكر و CHF علاج نفسي. أجرت لجنة مستقلة تقييم أعمى للأحداث ذات الصلة السوائل (بما في ذلك قصور القلب الاحتقاني) ومستشفيات القلب والأوعية الدموية وفقا لمعايير محددة مسبقا (الفصل). منفصل عن الفصل ، تم الإبلاغ عن أحداث سلبية أخرى في القلب والأوعية الدموية من قبل المحققين. على الرغم من عدم وجود اختلاف في المعاملة في التغيير من خط الأساس لكسور طرد ، وأكثر من ذلك وقد لوحظت أحداث سلبية القلب والأوعية الدموية بعد العلاج مع AVANDIA مقارنة مع الدواء الوهمي خلال دراسة لمدة 52 أسبوع. (انظر الجدول 1.)
الجدول 1. أحداث سلبية القلب والأوعية الدموية الناشئة في المرضى الذين يعانون من قصور القلب الاحتقاني (NYHA من الدرجة الأولى والثانية) تعامل مع AVANDIA أو وهمي (بالإضافة إلى الخلفية المضادة لمرض السكر وعلاج CHF)
| أحداث | أفانديا ن = 110 ن (٪) |
الوهمي العدد = 114 ن (٪) |
| الفصل فيها | ||
| وفيات القلب والأوعية الدموية | 5 (5%) | 4 (4%) |
| فرنك سويسري تفاقم | 7 (6%) | 4 (4%) |
| - مع المستشفى ليلة وضحاها | 5 (5%) | 4 (4%) |
| - بدون دخول المستشفى ليلاً | 2 (2%) | 0 (0%) |
| وذمة جديدة أو تفاقم | 28 (25%) | 10 (9%) |
| ضيق التنفس الجديد أو المتفاقم | 29 (26%) | 19 (17%) |
| زيادة في دواء CHF | 36 (33%) | 20 (18%) |
| الاستشفاء القلبي الوعائي | 21 (19%) | 15 (13%) |
| أبلغ المحقق ، غير محكم | ||
| الأحداث السلبية الإقفارية | 10 (9%) | 5 (4%) |
| - احتشاء عضلة القلب | 5 (5%) | 2 (2%) |
| - خناق | 6 (5%) | 3 (3%) |
| * يشمل الاستشفاء لأي سبب من أمراض القلب والأوعية الدموية. |
هو بطلان بدء AVANDIA في المرضى الذين يعانون من فشل القلب NYHA من الدرجة الثالثة أو الرابعة. لا ينصح AVANDIA في المرضى الذين يعانون من قصور القلب أعراض. [نرى تحذير محاصر.]
لم تتم دراسة المرضى الذين يعانون من متلازمة الشريان التاجي الحادة في التجارب السريرية التي تسيطر عليها. في ضوء احتمالية تطور قصور القلب لدى المرضى الذين يعانون من مرض الشريان التاجي الحاد ، فإن بدء مرض AVANDIA ليس كذلك ينصح به للمرضى الذين يعانون من حدث التاج الحاد ، ويجب أن يكون وقف AVANDIA خلال هذه المرحلة الحادة اعتبر.
لم تتم دراسة المرضى الذين يعانون من حالة القلب NYHA من الدرجة الثالثة والرابعة (مع أو بدون CHF) في التجارب السريرية التي تسيطر عليها. لا ينصح AVANDIA في المرضى الذين يعانون من حالة القلب NYHA من الدرجة الثالثة والرابعة.
نقص تروية عضلة القلب
التحليل التلوي من نقص تروية عضلة القلب في مجموعة من 42 التجارب السريرية
أجري التحليل التلوي بأثر رجعي لتقييم الأحداث السلبية القلب والأوعية الدموية ذكرت خلال 42 التجارب السريرية مزدوجة التعمية ، العشوائية ، التي تسيطر عليها (يعني مدة 6 أشهر).1
وقد أجريت هذه الدراسات لتقييم فعالية خفض الجلوكوز في داء السكري من النوع 2 ، ولم يحدث في المحاكمات المخططة مستقبلاً للأحداث القلبية الوعائية. وكانت بعض التجارب التي تسيطر عليها وهمي ، وتستخدم بعض الأدوية المضادة لمرض السكر عن طريق الفم النشطة للضوابط. وشملت الدراسات التي تسيطر عليها وهمي التجارب أحادي (أحادي مع AVANDIA مقابل العلاج الوهمي أحادي) والتجارب الإضافية (AVANDIA أو وهمي ، إضافة إلى السلفونيل يوريا ، الميتفورمين ، أو الأنسولين). شملت دراسات المكافحة الفعالة تجارب أحادية (أحادي مع AVANDIA مقابل السلفونيل يوريا أو الميتفورمين العلاج أحاديًا) والتجارب الإضافية (AVANDIA plus السلفونيل يوريا أو AVANDIA plus الميتفورمين ، مقابل السلفونيل يوريا زائد الميتفورمين). تم تضمين ما مجموعه 1437 مريضا (8،604 في مجموعات العلاج التي تحتوي على AVANDIA ، 5633 في مجموعات المقارنة) ، مع 4،143 سنة من المريض من التعرض ل AVANDIA و 2675 من المريض سنوات من التعرض ل المقارنة. وشملت الأحداث الإقفارية عضلة القلب الذبحة الصدرية ، الذبحة الصدرية تفاقم ، الذبحة الصدرية غير المستقرة ، السكتة القلبية ، ألم في الصدر ، التاجي انسداد الشريان ، ضيق التنفس ، احتشاء عضلة القلب ، تخثر الشريان التاجي ، نقص تروية عضلة القلب ، مرض الشريان التاجي ، الشريان التاجي اضطراب. في هذا التحليل ، يزداد خطر الإصابة بنقص تروية عضلة القلب مع AVANDIA مقابل المقارنة المجمعة وقد لوحظ (2 ٪ AVANDIA مقابل 1.5 ٪ المقارنة ، ونسبة الأرجحية 1.4 ، فاصل الثقة 95 ٪ [CI] 1.1 ، 1.8). ولوحظ وجود خطر متزايد من الأحداث الدماغية عضلة القلب مع AVANDIA في الدراسات التي تسيطر عليها وهمي ، ولكن ليس في الدراسات التي تسيطر عليها النشطة. (انظر الشكل 1.)
ولوحظ وجود خطر متزايد أكبر من الأحداث الدماغية عضلة القلب في الدراسات حيث تم إضافة AVANDIA للأنسولين (2.8٪ للأنسولين زائد الأنسولين مقابل 1.4٪ للأنسولين الوهميين ، [أو 2.1 ، 95٪ CI 0.9 ، 5.1]). يعكس هذا الخطر المتزايد اختلافًا قدره 3 أحداث لكل 100 مريض (95٪ CI -0.1 ، 6.3) بين مجموعات العلاج. [نرى المحاذير والإحتياطات.]
شكل 1. مؤامرة الغابات من نسب الأرجحية (فواصل الثقة 95 ٪) للأحداث نقص تروية عضلة القلب في التحليل التلوي من 42 التجارب السريرية
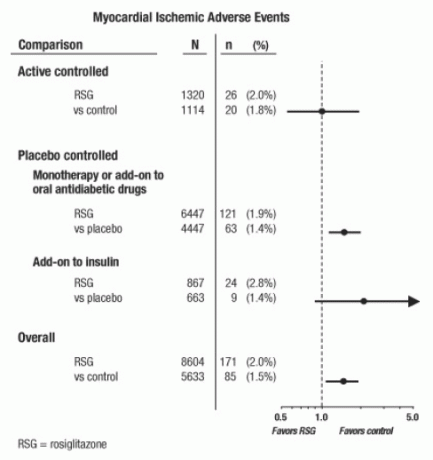
ولوحظ وجود خطر متزايد أكبر من نقص تروية عضلة القلب في المرضى الذين تلقوا AVANDIA والعلاج نترات الخلفية. بالنسبة لـ AVANDIA (N = 361) مقابل التحكم (N = 244) في مستخدمي النترات ، كانت نسبة الأرجحية 2.9 (95٪ CI 1.4 ، 5.9) ، بينما بالنسبة للمستخدمين غير النترات (حوالي 14000 مريض إجمالي) ، كانت نسبة الأرجحية 1.3 (95٪ CI 0.9 ، 1.7). يمثل هذا الخطر المتزايد فرقًا من 12 حدثًا إقفاريًا في عضلة القلب لكل 100 مريض (95٪ CI 3.3 ، 21.4). كان معظم مستخدمي النترات مصابين بأمراض القلب التاجية. من بين المرضى الذين يعانون من مرض الشريان التاجي المعروف والذين لم يخضعوا للعلاج بالنترات ، لم تظهر زيادة في خطر حدوث نقص تروية عضلة القلب في حالة AVANDIA مقابل المقارنة.
الأحداث الإقفارية عضلة القلب في المحاكمات الكبيرة العشوائية المحتملين على المدى الطويل من AVANDIA
تم تقييم البيانات من 3 تجارب كبيرة أخرى ، طويلة الأجل ، المحتملين ، العشوائية ، التي تسيطر عليها AVANDIA بشكل منفصل عن التحليل التلوي. تتضمن هذه التجارب الثلاثة ما مجموعه 14،067 مريض (مجموعات العلاج التي تحتوي على AVANDIA N = 6،311 ، مقارنة مجموعات N = 7،756) ، مع التعرض للمريض في السنة من 21803 مريض-سنة ل AVANDIA و 25،998 سنة للمريض المقارنة. تجاوزت مدة المتابعة 3 سنوات في كل دراسة. كانت ADOPT (تجربة تطور مرضى السكري) عبارة عن دراسة عشوائية نشطت من 4 إلى 6 سنوات في مرضى تم تشخيصهم مؤخرًا مصابين بداء السكري من النوع 2 في العلاج الدوائي.
لقد كانت تجربة فعالة وسلامة عامة تم تصميمها لدراسة متانة
AVANDIA كعلاج وحيد (N = 1،456) للسيطرة على نسبة السكر في الدم في مرض السكري من النوع 2 ، مع أذرع المقارنة لعقار وحيد السلفونيل يوريا (N = 1،441) وحيدة الميتفورمين (N = 1،454). كان DREAM (تقييم الحد من مرض السكري مع روزيجليتازون وراميريل دواء ، تقرير منشور 2) 3 إلى دراسة عشوائية لمدة 5 سنوات يتم التحكم فيها بالغفل في المرضى الذين يعانون من ضعف تحمل الجلوكوز و / أو ضعف الصيام الجلوكوز. كان لديه تصميم 2 × 2 عاملي ، يهدف إلى تقييم تأثير AVANDIA ، وبشكل منفصل عن راميبريل (مثبط أنزيم يحول أنجيوتنسين [ACEI]) ، على تطور مرض السكري العلني. في DREAM ، كان 2،635 مريضا في مجموعات العلاج التي تحتوي على AVANDIA ، و 2634 كانوا في مجموعات العلاج لا تحتوي على تم نشر نتائج AVANDIA.Interim 3 لـ RECORD (تقييم Rosiglitazone من أجل النتائج القلبية وتنظيم نسبة السكر في الدم في داء السكري) ، دراسة مستمرة مفتوحة لمدة 6 سنوات لنتائج القلب والأوعية الدموية في مرضى السكري من النوع 2 مع علاج متوسط مدة 3.75 سنة. يشمل السجل المرضى الذين فشلوا في علاج الميتفورمين أو السلفونيل يوريا. أولئك الذين فشلوا الميتفورمين تم اختيارهم بصورة عشوائية لتلقي إما AVANDIA الوظيفة الإضافية أو السلفونيل يوريا الإضافية ، وأولئك الذين فشلوا السلفونيل يوريا يتم اختيارهم بصورة عشوائية لتلقي إما AVANDIA الإضافي أو الوظيفة الإضافية الميتفورمين. في RECORD ، هناك ما مجموعه 2220 مريضًا يتلقون AVANDIA الإضافي ، و 2227 مريضًا في أحد أنظمة العلاج الإضافي التي لا تحتوي على AVANDIA.
بالنسبة لهذه التجارب الثلاثة ، أجريت التحليلات باستخدام مركب من الأحداث القلبية الوعائية الرئيسية الضار (احتشاء عضلة القلب ، أو الوفاة القلبية الوعائية ، أو السكتة الدماغية) ، ويشار إليها فيما بعد باسم MACE. اختلفت نقطة النهاية هذه عن نقطة النهاية الواسعة لأحداث نقص تروية عضلة القلب ، وكان أكثر من نصفها من الذبحة الصدرية. وشملت احتشاء عضلة القلب احتشاء عضلة القلب المميتة وغير المميتة بالإضافة إلى الموت المفاجئ. كما هو مبين في الشكل 2 ، لم تكن نتائج نقاط النهاية الثلاثة (MACE ، MI ، والوفيات الكلية) مختلفة إحصائياً بشكل كبير بين AVANDIA والمقارنات.
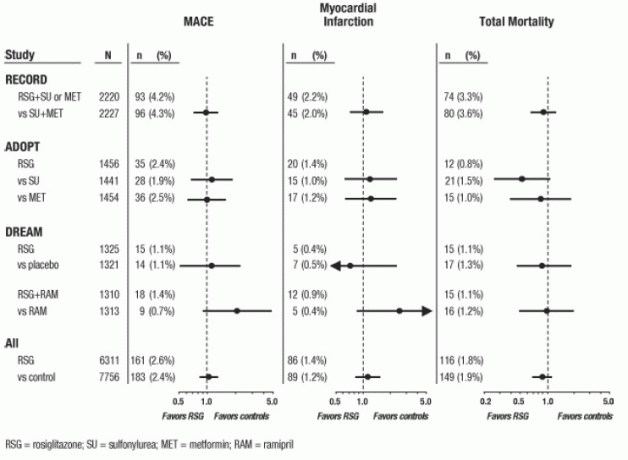
في التحليلات الأولية لتجربة DREAM ، كانت نسبة حدوث أحداث القلب والأوعية الدموية أعلى بين الأشخاص الذين تلقى AVANDIA في تركيبة مع راميبريل من بين الأشخاص الذين تلقوا راميبريل وحده ، كما هو موضح في الشكل 2. لم يتم تأكيد هذا الاكتشاف في ADOPT و RECORD (التجارب التي يتم التحكم فيها بشكل نشط في مرضى السكري) حيث أبلغ 30٪ و 40٪ من المرضى على التوالي عن استخدام مثبطات ACE في الأساس.
في مجملها ، فإن البيانات المتاحة عن خطر نقص تروية عضلة القلب ليست حاسمة. استنتاجات نهائية بشأن هذا الخطر تنتظر الانتهاء من دراسة نتائج القلب والأوعية الدموية مصممة بشكل كاف.
لم تكن هناك دراسات سريرية تثبت وجود أدلة قاطعة على الحد من مخاطر الأوعية الدموية الكبرى مع AVANDIA أو أي دواء آخر مضاد لمرض السكر عن طريق الفم.
قصور القلب الاحتقاني ونقص تروية عضلة القلب أثناء التناول مع أفانديا مع الأنسولين
في الدراسات التي تم فيها إضافة AVANDIA إلى الأنسولين ، زاد AVANDIA من خطر قصور القلب الاحتقاني ونقص تروية عضلة القلب. (انظر الجدول 2.)
لا ينصح Coadministration من AVANDIA والأنسولين. [نرى مؤشرات والاستخدام و المحاذير والإحتياطات.]
في خمسة ، 26 أسبوعًا ، تجارب عشوائية محكومة مزدوجة التعمية تم تضمينها في التحليل التلوي [انظر المحاذير والإحتياطات] ، تم اختيارهم بصورة عشوائية المرضى الذين يعانون من مرض السكري من النوع 2 إلى الترافق من AVANDIA والأنسولين (N = 867) أو الأنسولين (N = 663). في هذه التجارب الخمس ، تمت إضافة AVANDIA إلى الأنسولين. شملت هذه التجارب المرضى الذين يعانون من مرض السكري منذ فترة طويلة (متوسط مدة 12 سنة) وارتفاع معدل انتشار الموجودة مسبقا الحالات الطبية ، بما في ذلك الاعتلال العصبي المحيطي ، واعتلال الشبكية ، وأمراض نقص تروية القلب ، وأمراض الأوعية الدموية ، والقلب الاحتقاني بالفشل. كان العدد الإجمالي للمرضى الذين يعانون من قصور القلب الاحتقاني الناشئ 21 (2.4 ٪) و 7 (1.1 ٪) في مجموعات AVANDIA بالإضافة إلى الأنسولين والأنسولين ، على التوالي. كان العدد الإجمالي للمرضى الذين يعانون من نقص تروية عضلة القلب الناشئة 24 (2.8 ٪) و 9 (1.4 ٪) في AVANDIA بالإضافة إلى مجموعات الأنسولين والأنسولين ، على التوالي (OR 2.1 [95 ٪ CI 0.9 ، 5.1]). على الرغم من أن معدل حدوث قصور القلب الاحتقاني ونقص تروية عضلة القلب كان منخفضًا في الدراسة السكان ، وكان معدل الحدث باستمرار 2 أضعاف أو أعلى مع إدارة AVANDIA و الأنسولين. وقد لوحظت هذه الأحداث القلب والأوعية الدموية في كل من جرعات 4 ملغ و 8 ملغ يوميا من AVANDIA. (انظر الجدول 2.)
الجدول 2. حدوث أحداث القلب والأوعية الدموية في 5 تجارب مضبوطة لإضافة AVANDIA لعلاج الأنسولين المعمول بها
| حدث* | AVANDIA + الأنسولين (ن = 867) ن (٪) |
الأنسولين (ن = 663) ن (٪) |
| فشل القلب الاحتقاني | 21 (2.4%) | 7 (1.1%) |
| نقص تروية عضلة القلب | 24 (2.8%) | 9 (1.4%) |
| مركب من موت القلب والأوعية الدموية ، احتشاء عضلة القلب ، أو السكتة الدماغية | 10 (1.2%) | 5 (0.8%) |
| السكتة الدماغية | 5 (0.6%) | 4 (0.6%) |
| احتشاء عضلة القلب | 4 (0.5%) | 1 (0.2%) |
| موت القلب والأوعية الدموية | 4 (0.5%) | 1 (0.2%) |
| كل الوفيات | 6 (0.7%) | 1 (0.2%) |
| * الأحداث ليست حصرية ؛ أي أن المريض المصاب بوفاة القلب والأوعية الدموية بسبب احتشاء عضلة القلب سيُحسب في 4 فئات من الأحداث (نقص تروية عضلة القلب ؛ الموت القلبي الوعائي ، احتشاء عضلة القلب أو السكتة الدماغية ؛ احتشاء عضلة القلب؛ وفاة القلب والأوعية الدموية). |
في تجربة سادسة ، لمدة 24 أسبوعًا ، مضبوطة ، عشوائية مزدوجة التعمية لـ AVANDIA و إدارة الأنسولين ، تمت إضافة الأنسولين إلى AVANDAMET® (ماليات روسيجليتازون وميتفورمين حمض الهيدروكلوريك) (ن = 161) ومقارنة بالأنسولين بالإضافة إلى الغفل (ن = 158) ، بعد فترة تشغيل متواصلة لمدة 8 أسابيع مع AVANDAMET. تم استبعاد المرضى الذين يعانون من وذمة تتطلب العلاج الدوائي وأولئك الذين يعانون من قصور القلب الاحتقاني في الأساس وخلال فترة التشغيل.
في المجموعة التي تتلقى AVANDAMET plus الأنسولين ، كان هناك حدث نقص تروية عضلة القلب وموت مفاجئ واحد. لم يلاحظ أي نقص تروية عضلة القلب في مجموعة الأنسولين ، ولم يبلغ عن قصور القلب الاحتقاني في أي مجموعة العلاج.
الوذمة
يجب استخدام AVANDIA بحذر عند مرضى الوذمة. في دراسة سريرية للمتطوعين الأصحاء الذين تلقوا 8 ملغ من AVANDIA مرة واحدة يوميًا لمدة 8 أسابيع ، كانت هناك زيادة ذات دلالة إحصائية في متوسط حجم البلازما مقارنة مع الدواء الوهمي.
بما أن الثيازوليدينونيز ، بما في ذلك روسيجليتازون ، يمكن أن يسبب احتباس السوائل ، مما قد يؤدي إلى تفاقم أو تؤدي إلى قصور القلب الاحتقاني ، يجب استخدام AVANDIA بحذر عند المرضى المعرضين لخطر الإصابة بالقلب بالفشل. يجب مراقبة المرضى بحثًا عن علامات وأعراض قصور القلب تحذير محاصر, المحاذير والإحتياطات ].
في التجارب السريرية الخاضعة للرقابة لمرضى السكري من النوع 2 ، تم الإبلاغ عن وذمة خفيفة إلى معتدلة في المرضى الذين عولجوا مع AVANDIA ، وقد تكون مرتبطة بالجرعة. كان المرضى الذين يعانون من الوذمة المستمرة أكثر عرضة للإصابة بأحداث ضارة مرتبطة بالوذمة إذا بدأت في العلاج المركب مع الأنسولين و AVANDIA [انظر ردود الفعل الضارة].
زيادة الوزن
شوهدت زيادة الوزن المرتبطة بالجرعة مع AVANDIA وحدها وبالاقتران مع عوامل سكر الدم الأخرى (الجدول 3). آلية زيادة الوزن غير واضحة ، لكن من المحتمل أن تشتمل على مزيج من احتباس السوائل وتراكم الدهون.
في تجربة ما بعد التسويق ، كانت هناك تقارير عن زيادات سريعة غير عادية في الوزن وزيادة تزيد عن تلك الملاحظة بشكل عام في التجارب السريرية. يجب تقييم المرضى الذين يعانون من هذه الزيادات لتراكم السوائل والأحداث المتعلقة بالحجم مثل الوذمة المفرطة وفشل القلب الاحتقاني [انظر تحذير محاصر].
الجدول 3. تغيرات في الوزن (كجم) من خط الأساس عند نقطة النهاية أثناء التجارب السريرية
| وحيد | المدة الزمنية | مجموعة التحكم | أفانديا 4 ملغ الوسيط (25 ، 75 المئوية) |
أفانديا 8 ملغ الوسيط (25 ، 75 المئوية) |
|
| الوسيط (25 ، 75 المئوية) | |||||
| 26 أسبوع | الوهمي | -0.9 (-2.8, 0.9) ن = 210 |
1.0 (-0.9, 3.6) ن = 436 |
3.1 (1.1, 5.8) ن = 439 |
|
| 52 أسبوع | السلفونيل يوريا | 2.0 (0, 4.0) ن = 173 |
2.0 (-0.6, 4.0) ن = 150 |
2.6 (0, 5.3) ن = 157 |
|
| الجمع بين العلاج | |||||
| السلفونيل يوريا | 24-26 أسبوع | السلفونيل يوريا | 0 (-1.0, 1.3) ن = 1،155 |
2.2 (0.5, 4.0) ن = 613 |
3.5 (1.4, 5.9) ن = 841 |
| ميتفورمين | 26 أسبوع | ميتفورمين | -1.4 (-3.2, 0.2) ن = 175 |
0.8 (-1.0, 2.6) ن = 100 |
2.1 (0, 4.3) ن = 184 |
| الأنسولين | 26 أسبوع | الأنسولين | 0.9 (-0.5, 2.7) ن = 162 |
4.1 (1.4, 6.3) ن = 164 |
5.4 (3.4, 7.3) ن = 150 |
| سلفونيلوريا + ميتفورمين | 26 أسبوع | سلفونيلوريا + ميتفورمين | 0.2 (-1.2, 1.6) ن = 272 |
2.5 (0.8, 4.6) ن = 275 |
4.5 (2.4, 7.3) ن = 276 |
في غضون من 4 إلى 6 سنوات ، علاج وحيد ، تجربة مقارنة (ADOPT) للمرضى الذين تم تشخيصهم مؤخرًا بمرض السكري من النوع 2 لم يتم علاجهم مسبقًا بالأدوية المضادة للسكري [انظر دراسة سريريةس] ، تغيير الوزن المتوسط (25العاشر, 75العاشر النسب المئوية) من خط الأساس في 4 سنوات كانت 3.5 كجم (0.0 ، 8.1) ل AVANDIA ، 2.0 كجم (-1.0 ، 4.8) للجليبريد ، و -2.4 كجم (-5.4 ، 0.5) للميتفورمين.
في دراسة استمرت 24 أسبوعًا على مرضى الأطفال الذين تتراوح أعمارهم بين 10 و 17 عامًا عولجوا بـ AVANDIA من 4 إلى 8 ملغ يوميًا ، بزيادة متوسطة في الوزن قدرها 2.8 كجم (25)العاشر, 75العاشر النسب المئوية: 0.0 ، 5.8) تم الإبلاغ عنها.
آثار الكبد
يجب قياس إنزيمات الكبد قبل بدء العلاج مع AVANDIA في جميع المرضى وبعد ذلك بشكل دوري وفقًا للحكم السريري لأخصائي الرعاية الصحية. لا ينبغي أن يبدأ العلاج مع AVANDIA في المرضى الذين يعانون من زيادة مستويات إنزيم الكبد الأساسي (ALT> 2.5X الحد الأعلى الطبيعي). المرضى الذين يعانون من إنزيمات الكبد المرتفعة بشكل معتدل (مستويات ALT limit ¤ 2.5X الحد العلوي الطبيعي) عند خط الأساس أو أثناء العلاج مع AVANDIA يجب تقييمها لتحديد سبب إنزيم الكبد ارتفاع. يجب أن يبدأ بحذر ، أو استمرار ، العلاج مع AVANDIA في المرضى الذين يعانون من ارتفاع انزيم الكبد الخفيف بحذر وتشمل المتابعة السريرية الدقيقة ، بما في ذلك مراقبة إنزيم الكبد ، لتحديد ما إذا كانت ارتزيمات إنزيمات الكبد ستحل أم لا تتفاقم. إذا زادت مستويات ALT في أي وقت إلى 3X الحد الأعلى الطبيعي للمرضى الذين يتلقون العلاج باستخدام AVANDIA ، فيجب إعادة فحص مستويات إنزيم الكبد في أقرب وقت ممكن. إذا بقيت مستويات ALT> 3X الحد الأعلى الطبيعي ، فيجب إيقاف العلاج باستخدام AVANDIA.
إذا ظهرت على أي مريض أعراض تشير إلى خلل وظيفي كبدي ، والذي قد يشمل الغثيان غير المبرر ، والتقيؤ ، وآلام البطن ، والتعب ، وفقدان الشهية و / أو البول الداكن ، يجب فحص إنزيمات الكبد. ينبغي أن يسترشد قرار مواصلة المريض في العلاج مع AVANDIA بالحكم السريري في انتظار التقييمات المختبرية. إذا لوحظت اليرقان ، يجب التوقف عن العلاج بالعقاقير. [نرى ردود الفعل الضارة.]
وذمة البقعة الصفراء
تم الإبلاغ عن وذمة البقعة الصفراء في تجربة ما بعد البيع في بعض مرضى السكري الذين كانوا يتناولون AVANDIA أو ثيازيدوليدين آخر. بعض المرضى الذين يعانون من عدم وضوح الرؤية أو انخفاض حدة البصر ، ولكن يبدو أن بعض المرضى قد تم تشخيصهم في فحص طب العيون الروتيني. وكان معظم المرضى وذمة محيطية في وقت تم تشخيص وذمة البقعة الصفراء. كان بعض المرضى تحسنا في وذمة البقعة الصفراء بعد التوقف عن ثيازوليدينيوني بهم. يجب على مرضى السكري إجراء فحوصات منتظمة للعين من قبل أخصائي طب العيون ، وفقًا لمعايير رعاية جمعية السكري الأمريكية. بالإضافة إلى ذلك ، يجب إحالة أي مريض مصاب بالسكري يقوم بالإبلاغ عن أي نوع من الأعراض البصرية على الفور إلى طبيب عيون ، بغض النظر عن الأدوية الأساسية للمريض أو النتائج المادية الأخرى. [نرى ردود الفعل الضارة.]
الكسور
في دراسة مقارنة من 4 إلى 6 سنوات (ADOPT) للسيطرة على نسبة السكر في الدم مع وحيد في المرضى الذين يعانون من المخدرات في الآونة الأخيرة تشخيص داء السكري من النوع 2 ، لوحظ حدوث زيادة في كسر العظام لدى النساء المريضات اللائي يتناولن أفانديا. خلال فترة 4-6 سنوات ، كانت نسبة حدوث كسر العظام في الإناث 9.3 ٪ (60/645) ل AVANDIA مقابل 3.5 ٪ (21/605) للجليبريد و 5.1 ٪ (30/590) للميتفورمين. وقد لوحظت هذه الزيادة في معدل الإصابة بعد السنة الأولى من العلاج واستمرت خلال فترة الدراسة. حدثت غالبية الكسور في النساء اللواتي تلقين AVANDIA في الجزء العلوي من الذراع واليد والقدم. تختلف مواقع الكسر هذه عن تلك المرتبطة عادة بهشاشة العظام بعد انقطاع الطمث (مثل الورك أو العمود الفقري). لم يلاحظ أي زيادة في معدلات الكسر في الرجال الذين عولجوا مع AVANDIA. يجب مراعاة خطر الكسر في رعاية المرضى ، وخاصة المرضى الإناث ، الذين تم علاجهم به AVANDIA ، والاهتمام الذي يولي لتقييم والحفاظ على صحة العظام وفقا للمعايير الحالية لل رعاية.
آثار الدم
حدث انخفاض في متوسط الهيموغلوبين والهيماتوكريت بطريقة مرتبطة بالجرعة في المرضى البالغين الذين عولجوا بـ AVANDIA [انظر ردود الفعل الضارة]. قد تكون ذات صلة التغييرات إلى زيادة حجم البلازما لوحظ مع العلاج مع AVANDIA.
مرض السكري ومراقبة نسبة الجلوكوز في الدم
قد يتعرض المرضى الذين يتلقون AVANDIA بالاشتراك مع عوامل أخرى لنقص السكر في الدم لخطر الإصابة بنقص السكر في الدم ، وقد يكون من الضروري إجراء تخفيض في جرعة العامل المصاحب.
يجب إجراء الصيام الدورية لجلوكوز الدم وقياسات HbA1c لمراقبة الاستجابة العلاجية.
الإباضة
قد يؤدي العلاج بـ AVANDIA ، مثله مثل الثيازيدوليديون الآخر ، إلى الإباضة في بعض النساء اللاتي يسبن انقطاع الطمث. نتيجة لذلك ، قد يكون هؤلاء المرضى معرضين لخطر متزايد للحمل أثناء تناول AVANDIA [انظر استخدام في السكان محددة]. وبالتالي ، ينبغي التوصية وسائل منع الحمل المناسبة في النساء قبل انقطاع الطمث. لم يتم التحقيق في هذا التأثير المحتمل على وجه التحديد في الدراسات السريرية ؛ لذلك ، وتكرار هذا الحدوث غير معروف.
على الرغم من عدم التوازن الهرموني الذي شوهد في الدراسات قبل السريرية [انظر علم السموم غير الإكلينيكي] ، الأهمية السريرية لهذا الاكتشاف غير معروفة. في حالة حدوث خلل وظيفي غير متوقع في الدورة الشهرية ، يجب مراجعة فوائد العلاج المستمر مع AVANDIA.
أعلى
ردود الفعل السلبية
تجربة التجارب السريرية
بالغ
في التجارب السريرية ، تم علاج ما يقرب من 9،900 مريض يعانون من مرض السكري من النوع 2 مع AVANDIA.
المحاكمات قصيرة الأجل لـ AVANDIA كعلاج وحيد وفي تضافر مع عوامل أخرى لنقص السكر في الدم
يوضح الجدول 4 حالات الإصابة وأنواع الأحداث السلبية التي تم الإبلاغ عنها في التجارب السريرية قصيرة المدى لـ AVANDIA كعلاج وحيد.
الجدول 4. الأحداث الضائرة (حوالي 5 ٪ في أي مجموعة علاجية) تم الإبلاغ عنها من قبل المرضى في تجارب سريرية قصيرة الأجل مزدوجة التعمية مع AVANDIA كعلاج وحيد
| مصطلح المفضل | أفانديا وحيد العدد = 2526 % |
الوهمي ن = 601 % |
ميتفورمين العدد = 225 % |
Sulfonylureasâ € ن = 626 % |
| عدوى الجهاز التنفسي العلوي | 9.9 | 8.7 | 8.9 | 7.3 |
| إصابة | 7.6 | 4.3 | 7.6 | 6.1 |
| صداع الراس | 5.9 | 5.0 | 8.9 | 5.4 |
| ألم في الظهر | 4.0 | 3.8 | 4.0 | 5.0 |
| ارتفاع السكر في الدم | 3.9 | 5.7 | 4.4 | 8.1 |
| إعياء | 3.6 | 5.0 | 4.0 | 1.9 |
| إلتهاب الجيب | 3.2 | 4.5 | 5.3 | 3.0 |
| إسهال | 2.3 | 3.3 | 15.6 | 3.0 |
| نقص سكر الدم | 0.6 | 0.2 | 1.3 | 5.9 |
|
* تراوحت التجارب قصيرة الأجل من 8 أسابيع إلى 1 سنة. †يشمل المرضى الذين يتلقون glyburide (N = 514) ، gliclazide (N = 91) ، أو glipizide (N = 21). |
وعموما ، ذكرت أنواع ردود الفعل السلبية دون النظر إلى السببية عندما تم استخدام AVANDIA في تركيبة مع السلفونيل يوريا أو الميتفورمين كانت مماثلة لتلك أثناء وحيد أفانديا.
تميل إلى الإبلاغ عن أحداث فقر الدم وذمة في كثير من الأحيان في جرعات أعلى ، وكانت عموما خفيفة إلى معتدلة في شدة وعادة لا تتطلب التوقف عن العلاج مع AVANDIA.
في دراسات مزدوجة التعمية ، تم الإبلاغ عن فقر الدم في 1.9 ٪ من المرضى الذين يتلقون AVANDIA كعلاج وحيد مقارنة مع 0.7 ٪ على الدواء الوهمي ، و 0.6 ٪ على السلفونيل يوريا ، و 2.2 ٪ على الميتفورمين. كانت تقارير فقر الدم أكبر في المرضى الذين عولجوا بمزيج من AVANDIA والميتفورمين (7.1 ٪) ومع مزيج من AVANDIA وسلفونيل يوريا زائد الميتفورمين (6.7 ٪) مقارنة مع وحيد مع AVANDIA أو في تركيبة مع السلفونيل يوريا (2.3%). انخفاض مستويات الهيموغلوبين / الهيماتوكريت قبل المعالجة في المرضى المسجلين في مجموعة الميتفورمين قد تكون التجارب السريرية قد أسهمت في ارتفاع معدل الإبلاغ عن فقر الدم في هذه الدراسات [انظر ردود الفعل الضارة].
في التجارب السريرية ، تم الإبلاغ عن وذمة في 4.8 ٪ من المرضى الذين يتلقون AVANDIA كعلاج وحيد مقارنة مع 1.3 ٪ على الدواء الوهمي ، و 1.0 ٪ على السلفونيل يوريا ، و 2.2 ٪ على الميتفورمين. كان معدل الإبلاغ عن الوذمة أعلى بالنسبة لـ AVANDIA 8 mg في توليفات السلفونيل يوريا (12.4٪) مقارنة بالتوليفات الأخرى ، باستثناء الأنسولين. تم الإبلاغ عن ذمة في 14.7 ٪ من المرضى الذين يتلقون AVANDIA في تجارب الجمع بين الأنسولين مقارنة مع 5.4 ٪ على الأنسولين وحده. حدثت تقارير عن بداية جديدة أو تفاقم قصور القلب الاحتقاني بمعدلات قدرها 1 ٪ للأنسولين وحده ، و 2 ٪ (4 ملغ) و 3 ٪ (8 ملغ) للأنسولين في تركيبة مع AVANDIA [انظر تحذير محاصر و المحاذير والإحتياطات].
في دراسات العلاج المركب المضبوطة مع السلفونيل يوريا ، تم الإبلاغ عن أعراض سكر الدم خفيفة إلى متوسطة ، والتي يبدو أنها ذات صلة بالجرعة. تم سحب عدد قليل من المرضى لنقص السكر في الدم (أقل من 1 ٪) واعتبر عدد قليل من نوبات نقص السكر في الدم لتكون شديدة (<1 ٪). كان نقص السكر في الدم هو الحدث الضار الأكثر شيوعًا في تجارب تركيبة الأنسولين بجرعة ثابتة ، على الرغم من انسحاب عدد قليل من المرضى بسبب نقص السكر في الدم (4 من 408 للأنسولين زائد و 1 من 203 للأنسولين وحده). كانت معدلات نقص السكر في الدم ، التي أكدها تركيز السكر في الدم الشعري - 50 ملغ / ديسيلتر ، 6 ٪ للأنسولين وحده و 12 ٪ (4 ملغ) و 14 ٪ (8 ملغ) للأنسولين في تركيبة مع AVANDIA. [نرى المحاذير والإحتياطات.]
تجربة طويلة الأجل من AVANDIA كعلاج وحيد
قارنت دراسة من 4 إلى 6 سنوات (ADOPT) استخدام AVANDIA (n = 1،456) ، glyburide (n = 1،441) ، و metformin (n = 1،454) كـ وحيد في المرضى الذين تم تشخيصهم مؤخرًا بمرض السكري من النوع 2 والذين لم يعالجوا من قبل بمضادات السكر أدوية. يعرض الجدول 5 ردود الفعل السلبية دون النظر إلى السببية ؛ يتم التعبير عن المعدلات لكل 100 سنة من سنوات التعرض (PY) للتعبير عن الاختلافات في التعرض لدراسة الدواء عبر مجموعات العلاج الثلاث.
في ADOPT ، تم الإبلاغ عن كسور في عدد أكبر من النساء الذين عولجوا مع AVANDIA (9.3 ٪ ، 2.7 / 100 سنوات المريض) مقارنةً بالجليبريد (3.5٪ ، 1.3 / 100 سنوات المريض) أو الميتفورمين (5.1٪ ، 1.5 / 100 المريض عاما).
تم الإبلاغ عن غالبية الكسور في النساء اللائي تلقين روزيجليتازون في أعلى الذراع واليد والقدم. [نرى المحاذير والإحتياطات.] كانت نسبة حدوث الكسور التي لوحظت في المرضى الذكور مماثلة بين مجموعات العلاج الثلاثة.
الجدول 5. أحداث سلبية على العلاج (حوالي 5 أحداث / 100 مريض - سنة) في أي مجموعة علاج تم الإبلاغ عنها في تجربة سريرية لمدة 4 إلى 6 سنوات من AVANDIA كعلاج وحيد (ADOPT)
| أفانديا ن = 1،456 PY = 4،954 |
غليبوريد ن = 1،441 PY = 4،244 |
ميتفورمين ن = 1،454 PY = 4،906 |
|
| البلعوم الأنفي | 6.3 | 6.9 | 6.6 |
| ألم في الظهر | 5.1 | 4.9 | 5.3 |
| ألم مفصلي | 5.0 | 4.8 | 4.2 |
| ارتفاع ضغط الدم | 4.4 | 6.0 | 6.1 |
| عدوى الجهاز التنفسي العلوي | 4.3 | 5.0 | 4.7 |
| نقص سكر الدم | 2.9 | 13.0 | 3.4 |
| إسهال | 2.5 | 3.2 | 6.8 |
اخصائي اطفال
تم تقييم Avandia من أجل السلامة في تجربة فردية يتم التحكم فيها لمرضى الأطفال المصابين بداء السكري من النوع 2 حيث تم علاج 99 مع Avandia و 101 عولجوا بالميتفورمين. وكانت ردود الفعل السلبية الأكثر شيوعا (> 10 ٪) دون النظر إلى السببية إما Avandia أو الميتفورمين الصداع (17 ٪ مقابل 14 ٪) ، والغثيان (4 ٪ مقابل 11 ٪) ، والتهاب البلعوم الأنفي (3 ٪ مقابل 12 ٪) ، والإسهال (1 ٪ مقابل 13%). في هذه الدراسة ، تم الإبلاغ عن حالة واحدة من الحماض الكيتوني السكري في مجموعة الميتفورمين. بالإضافة إلى ذلك ، كان هناك 3 مرضى في مجموعة روسيجليتازون الذين لديهم FPG من 300 ملغ / دل ، 2 + كيتونوريا ، وفجوة أنيون مرتفعة.
تشوهات المختبر
الدموية
حدث انخفاض في متوسط الهيموغلوبين والهيماتوكريت بطريقة مرتبطة بالجرعة في المرضى البالغين المعالجين مع Avandia (يعني انخفاض في الدراسات الفردية بقدر 1.0 غرام / ديسيلتر الهيموغلوبين وبقدر 3.3 ٪ الهيماتوكريت). حدثت التغييرات في المقام الأول خلال الأشهر الثلاثة الأولى بعد بدء العلاج مع Avandia أو بعد زيادة الجرعة في Avandia. كانت الدورة الزمنية وحجم النقصان متشابهة في المرضى الذين عولجوا بمزيج من Avandia وغيره من عوامل سكر الدم أو العلاج الأحادي مع Avandia. كانت مستويات ما قبل العلاج من الهيموغلوبين والهيماتوكريت أقل في المرضى في دراسات تركيبة الميتفورمين وربما ساهمت في ارتفاع معدل الإبلاغ عن فقر الدم. في دراسة واحدة على مرضى الأطفال ، تم الإبلاغ عن انخفاض في الهيموغلوبين والهيماتوكريت (يعني انخفاض قدره 0.29 جم / دل و 0.95 ٪ ، على التوالي). كما تم الإبلاغ عن انخفاض طفيف في الهيموغلوبين والهيماتوكريت في مرضى الأطفال الذين عولجوا مع أفانديا. كما انخفض عدد خلايا الدم البيضاء بشكل طفيف في المرضى البالغين الذين عولجوا بأفانديا. قد تكون مرتبطة انخفاض في المعلمات الدموية لزيادة حجم البلازما لوحظ مع العلاج مع Avandia.
الدهون
وقد لوحظت تغييرات في الدهون في الدم بعد العلاج مع أفانديا في البالغين [انظر علم الصيدلة السريرية ]. تم الإبلاغ عن تغييرات طفيفة في المعلمات الدهون في الدم في الأطفال الذين عولجوا مع Avandia لمدة 24 أسبوعا.
مستويات الترانساميناز في الدم
في الدراسات السريرية المسبقة الموافقة على 4598 مريضاً عولجوا من Avandia (3600 مريض من التعرض) وعلى المدى الطويل 4- إلى دراسة مدتها 6 سنوات في 1،456 مريضًا عولجوا من Avandia (تعرض 4،954 مريضًا) ، لم يكن هناك دليل على وجود المخدرات تسمم الكبد.
في التجارب التي خضعت للموافقة المسبقة ، كان لدى 0.2٪ من المرضى الذين عولجوا مع Avandia ارتفاعات في ALT> 3X الحد الأعلى الطبيعي مقارنة بـ 0.2٪ على الدواء الوهمي و 0.5٪ على المقارنات النشطة. كانت ارتفاعات ALT في المرضى الذين عولجوا مع Avandia قابلة للانعكاس. تم العثور على فرط بيليروبين الدم في 0.3 ٪ من المرضى الذين عولجوا مع Avandia مقارنة مع 0.9 ٪ تعامل مع الدواء الوهمي و 1 ٪ في المرضى الذين عولجوا بمقارنات نشطة. في التجارب السريرية قبل الموافقة ، لم تكن هناك حالات من ردود الفعل المخدرات الخصية التي تؤدي إلى الفشل الكبدي. [نرى المحاذير والإحتياطات]
في تجربة ADOPT التي تمتد من 4 إلى 6 سنوات ، تم علاج المرضى الذين يعانون من Avandia (4،954 من سنوات تعرض المريض) ، أو glyburide (4،244 من سنوات تعرض المريض) ، أو الميتفورمين (4،906 سنة من التعرض للمريض) ، كعلاج وحيد ، كان له نفس معدل زيادة ALT إلى> 3X الحد الأعلى الطبيعي (0.3 لكل 100 مريض - سنة) مكشوف).
تجربة ما بعد التسويق
بالإضافة إلى ردود الفعل السلبية التي تم الإبلاغ عنها من التجارب السريرية ، تم تحديد الأحداث الموضحة أدناه أثناء استخدام Avandia بعد الموافقة عليها. نظرًا لأن هذه الأحداث يتم الإبلاغ عنها طوعًا من مجموعة سكانية ذات حجم غير معروف ، لا يمكن تقدير تواترها بشكل موثوق أو إقامة علاقة سببية دائمًا بالتعرض للعقاقير.
في المرضى الذين يتلقون العلاج الثيازيدوليديون ، من المحتمل حدوث أحداث سلبية خطيرة مع أو بدون نتيجة مميتة المتعلقة بتوسيع الحجم (على سبيل المثال ، قصور القلب الاحتقاني ، وذمة رئوية ، وانصباب جنبي) تم الإبلاغ عنها [نرى تحذير محاصر و المحاذير والإحتياطات].
هناك تقارير ما بعد التسويق مع Avandia من التهاب الكبد ، وارتفاع انزيمات الكبد إلى 3 أضعاف أو أكثر من الحد العلوي من الطبيعي ، والفشل الكبدي مع وبدون نتيجة مميتة ، على الرغم من أن السببية لم تكن أنشئت.
نادرا ما تم الإبلاغ عن طفح جلدي ، حكة ، شرى ، وذمة وعائية ، رد فعل الحساسية ، ومتلازمة ستيفنز جونسون.
كما تم تلقي تقارير عن ظهور الوذمة البقعية السكري الجديدة أو تفاقم حدة حدة البصر [انظر المحاذير والإحتياطات].
أعلى
تفاعل الأدوية
مثبطات ومحفزات CYP2C8
قد يؤدي مثبط CYP2C8 (على سبيل المثال ، gemfibrozil) إلى زيادة AUC من روزيجليتازون ومحفز لـ CYP2C8 (على سبيل المثال ، ريفامبين) قد يقلل من AUC من روزيجليتازون. لذلك ، إذا تم بدء أو إيقاف مثبط أو محفز CYP2C8 أثناء العلاج مع روزيجليتازون ، فقد تكون هناك حاجة إلى تغييرات في علاج مرض السكري بناءً على الاستجابة السريرية. [نرى صيدلية سريرية.]
أعلى
استخدام في السكان محددة
حمل
فئة الحمل C.
جميع حالات الحمل لها مخاطر خلفية من العيوب الخلقية أو الفقدان أو غيرها من النتائج الضارة بغض النظر عن التعرض للعقاقير. يتم زيادة خطر الخلفية هذا في حالات الحمل المعقدة بفرط سكر الدم وقد ينخفض مع التحكم الأيضي الجيد. من الضروري للمرضى الذين يعانون من مرض السكري أو تاريخ الإصابة بسكري الحمل الحفاظ على السيطرة الأيضية الجيدة قبل الحمل وطوال فترة الحمل. المراقبة الدقيقة للسيطرة على الجلوكوز ضرورية في هؤلاء المرضى. يوصي معظم الخبراء باستخدام الأنسولين وحيد العلاج أثناء الحمل للحفاظ على مستويات الجلوكوز في الدم قريبة من المعدل الطبيعي قدر الإمكان.
البيانات البشرية: تم الإبلاغ عن Rosiglitazone لعبور المشيمة البشرية و bedetectable في أنسجة الجنين. الأهمية السريرية لهذه النتائج غير معروفة. لا توجد دراسات كافية وجيدة التحكم في النساء الحوامل. لا ينبغي أن تستخدم AVANDIA أثناء الحمل.
الدراسات الحيوانية: لم يكن هناك أي تأثير على زرع أو الجنين مع العلاج روزيجليتازون أثناء الحمل المبكر في الفئران ، ولكن وارتبط العلاج خلال منتصف الحمل المتأخر مع وفاة الجنين وتأخر النمو في كل من الفئران والأرانب. لم يتم ملاحظة المسخية عند الجرعات التي تصل إلى 3 ملغ / كغ في الفئران و 100 ملغ / كغ في الأرانب (حوالي 20 و 75 مرة من الجين AUC البشري عند الحد الأقصى الموصى به من الجرعة اليومية البشرية على التوالي). تسبب روسيجليتازون في أمراض المشيمة عند الفئران (3 ملغ / كلغ / يوم). قللت معالجة الفئران أثناء الحمل من خلال الرضاعة من حجم القمامة ، وقابلية الولدان ، ونمو ما بعد الولادة ، مع تأخر النمو الذي يمكن عكسه بعد البلوغ. للتأثيرات على المشيمة ، الجنين / الجنين ، وذرية ، كانت الجرعة بدون تأثير 0.2 مغ / كغ / يوم في الفئران و 15 ملغ / كغ / يوم في الأرانب. تكون مستويات عدم التأثير هذه حوالي 4 أضعاف جسم الإنسان عند الحد الأقصى الموصى به من الجرعة اليومية البشرية. خفض روسيجليتازون عدد عمليات زرع الرحم وذرية حية عندما عولجت الفئران الأحداث في سن 40 ملغم / كغم / يوم من 27 يومًا حتى الوصول إلى مرحلة النضج الجنسي (حوالي 68 مرة من جسم الإنسان في اليوم بحد أقصى الموصى به يوميًا جرعة). وكان مستوى عدم التأثير 2 ملغ / كغ / يوم (حوالي 4 أضعاف AUC الإنسان في الحد الأقصى الجرعة اليومية الموصى بها). لم يكن هناك أي تأثير على بقاء أو نمو ما قبل الولادة أو بعدها.
العمل و الانجاز
تأثير روسيجليتازون على المخاض والولادة في البشر غير معروف.
الأمهات المرضعات
تم الكشف عن المواد المتعلقة بالمخدرات في الحليب من الفئران المرضعة. ليس من المعروف ما إذا كان يتم إفراز AVANDIA في حليب الإنسان. نظرًا لأن العديد من الأدوية تفرز في حليب الإنسان ، يجب عدم إعطاء AVANDIA إلى امرأة تمريض.
استخدام الأطفال
بعد الجري الوهمي ، بما في ذلك الإرشادات المتعلقة بالنظام الغذائي ، والأطفال الذين يعانون من داء السكري من النوع 2 ، والذين تتراوح أعمارهم بين 10 و 17 عامًا ولديهم مؤشر كتلة الجسم الأساسي (BMI) البالغ 33 تم اختيارهم بصورة عشوائية كجم / م للعلاج مع 2 ملغ مرتين يوميا من AVANDIA (ن = 99) أو 500 ملغ مرتين يوميا من الميتفورمين (ن = 101) في 24 سريرية مزدوجة التعمية محاكمة. كما هو متوقع ، انخفض FPG في المرضى الذين لا يعانون من مرض السكري (ن = 104) وزيادة في المرضى الذين انسحبت من الأدوية السابقة (عادة الميتفورمين) (ن = 90) خلال فترة التشغيل. بعد 8 أسابيع على الأقل من العلاج ، تضاعفت جرعة 49٪ من المرضى الذين عولجوا بـ AVANDIA و 55٪ من المرضى المعالجين بالميتفورمين إذا كانت FPG> 126 مجم / ديسيلتر. بالنسبة إلى إجمالي نية المرضى ، في الأسبوع 24 ، كان التغير المتوسط من خط الأساس في HbA1c -0.14 ٪ مع AVANDIA و -0.49 ٪ مع الميتفورمين. لم يكن هناك عدد كافٍ من المرضى في هذه الدراسة لتحديد ما إذا كان هؤلاء إحصائيًا
لوحظ يعني آثار العلاج كانت مماثلة أو مختلفة. اختلفت آثار العلاج بالنسبة للمرضى الذين لم يتلقوا العلاج بالعقاقير المضادة لمرض السكر وللمرضى الذين عولجوا سابقًا بالعلاج المضاد لمرض السكر (الجدول 6).
الجدول 6. الأسبوع 24 من FPG و HbA1c يتغيران من خط الأساس لآخر ملاحظة - يتم نقلهما إلى الأمام لدى الأطفال الذين يعانون من خط الأساس HbA1c> 6.5٪
| مرضى | المرضى الذين سبق علاجهم | |||
|
ميتفورمين ن = 40 |
روزيجليتازون العدد = 45 |
ميتفورمين العدد = 43 |
روزيجليتازون العدد = 32 |
|
| FPG (mg / dL) | ||||
| خط الأساس (الوسط) | 170 | 165 | 221 | 205 |
| التغيير من خط الأساس (الوسط) | -21 | -11 | -33 | -5 |
| فرق العلاج المعدل * (روزيغليتازون - الميتفورمين) - (95٪ CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| ٪ من المرضى الذين يعانون من انخفاض 30 ملغ / ديسيلتر من الأساس | 43% | 27% | 44% | 28% |
| HbA1c (٪) | ||||
| خط الأساس (الوسط) | 8.3 | 8.2 | 8.8 | 8.5 |
| التغيير من خط الأساس (الوسط) | -0.7 | -0.5 | -0.4 | 0.1 |
| فرق العلاج المعدل * (روزيغليتازون - الميتفورمين) - (95٪ CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| ٪ من المرضى الذين يعانون من انخفاض 0.7 ٪ من خط الأساس | 63% | 52% | 54% | 31% |
|
* التغيير من وسائل الأساس هو أقل المربعات يعني ضبط HbA1c الأساسي والجنس والمنطقة. †القيم الإيجابية للفرق لصالح الميتفورمين. |
تعتمد فروق المعاملة على مؤشر كتلة الجسم أو الوزن الأساسي بحيث ظهرت تأثيرات AVANDIA والميتفورمين بشكل أكبر مقارنة بين المرضى الأثقل. وكان متوسط زيادة الوزن 2.8 كجم مع روزيجليتازون و 0.2 كجم مع الميتفورمين [انظر المحاذير والإحتياطات]. اكتسب أربعة وخمسين في المئة من المرضى الذين عولجوا بالروزيجليتازون و 32 ٪ من المرضى الذين عولجوا بالميتفورمين ¥ 2 ¥ كجم ، و 33 ٪ من المرضى الذين عولجوا بالروسيجليتازون و 7 ٪ من المرضى الذين عولجوا بالميتفورمين ، حصلوا على 5 كجم على دراسة.
الأحداث السلبية التي لوحظت في هذه الدراسة موصوفة في ردود الفعل السلبية).
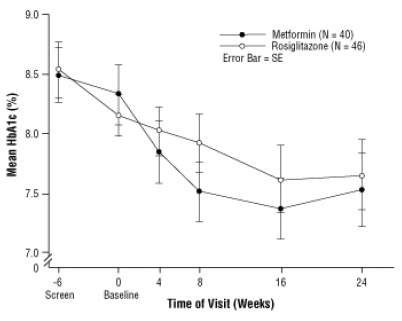
الشكل 3. يعني HbA1c مع مرور الوقت في دراسة استمرت 24 أسبوعًا لمرض AVANDIA والميتفورمين عند مرضى الأطفال - Sub-Group Drug-Naïve
استخدام المسنين
أظهرت نتائج التحليل الدوائي السكاني أن العمر لا يؤثر بشكل كبير على الدوائية للروسيجليتازون [انظر صيدلية سريرية]. لذلك ، لا يلزم إجراء تعديلات على الجرعة للمسنين. في التجارب السريرية التي تسيطر عليها ، لم يلاحظ وجود فروق شاملة في السلامة والفعالية بين كبار السن (â ¥ years 65 سنة) والمرضى الأصغر سنا (<65 سنة).
أعلى
جرعة زائدة
تتوفر بيانات محدودة فيما يتعلق بالجرعة الزائدة عند البشر. في الدراسات السريرية للمتطوعين ، تم إعطاء AVANDIA بجرعات فموية واحدة تصل إلى 20 ملغ وكان جيد التحمل. في حالة تناول جرعة زائدة ، يجب بدء العلاج الداعم المناسب كما تمليه الحالة السريرية للمريض.
أعلى
وصف
AVANDIA (روزيجليتازون ماليات) هو عامل مضاد لمرض السكر عن طريق الفم والذي يعمل في المقام الأول عن طريق زيادة حساسية الأنسولين. يحسن AVANDIA التحكم في نسبة السكر في الدم مع تقليل مستويات الأنسولين المتداولة.
لا يرتبط مصل روزيجليتازون كيميائيًا أو وظيفيًا بالسلفونيل يوريا ، أو بيغوانيدس ، أو مثبطات ألفا الجلوكوزيداز.
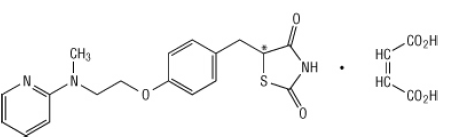
كيميائيا ، ماليات روسيجليتازون هي (±) -5 - [[4- [2- (ميثيل -2-بيريدينيلامينينو) إيثوكسي] فينيل] ميثيل] -2،4-ثيازيدوليدينوني ، (Z) -2-بوتينديوات (1: 1) مع الوزن الجزيئي من 473.52 (357.44 قاعدة حرة). يحتوي الجزيء على مركز حلزوني واحد وهو موجود كزميل سباق. نظرًا للتحويل السريع ، لا يمكن تمييز العوامل المتناهية وظيفيًا. الصيغة الهيكلية لملاوي روسيجليتازون هي:
الصيغة الجزيئية هي C18H19N3O3S-C4H4O4. روزيجليتازون ماليات هي مادة صلبة بلون أبيض إلى أبيض غير مصقول تتراوح درجة انصهارها من 122 إلى 123 درجة مئوية. قيم pKa من ماليات روسيجليتازون هي 6.8 و 6.1. وهو قابل للذوبان بسهولة في الإيثانول و حل مائي مخزنة مع درجة الحموضة من 2.3. الذوبان ينخفض مع زيادة درجة الحموضة في الفسيولوجية نطاق.
يحتوي كل قرص TILTAB مغلف بطبقة خماسية الفيلم على ماليات روسيجليتازون تعادل روسيجليتازون ، 2 ملغ ، 4 ملغ ، أو 8 ملغ ، للإعطاء عن طريق الفم. المكونات الخاملة هي: Hypromellose 2910 ، مونوهيدرات اللاكتوز ، ستيرات المغنيسيوم ، السليلوز الجريزوفولفين ، البولي إيثيلين غليكول 3000 ، جليكولات نشا الصوديوم وثاني أكسيد التيتانيوم وثلاثي الأسيتات و 1 أو أكثر مما يلي: أكاسيد الحديد الأحمر والأصفر الاصطناعية التلك.
أعلى
علم الصيدلة السريرية
آلية العمل
Rosiglitazone ، عضو في فئة الثيازيدوليدين من العوامل المضادة للسكري ، يحسن السيطرة على نسبة السكر في الدم من خلال تحسين حساسية الأنسولين. Rosiglitazone هو ناهض للغاية انتقائية وفعالة لمستقبلات غاما المنشط البيروكسيسوم (PPARγ). في البشر ، توجد مستقبلات PPAR في الأنسجة المستهدفة الرئيسية للقيام بالأنسولين مثل الأنسجة الدهنية والعضلات الهيكلية والكبد. ينشط تنشيط مستقبلات PPARγ النووية نسخ الجينات المستجيبة للأنسولين التي تشارك في التحكم في إنتاج الجلوكوز ونقله واستخدامه. بالإضافة إلى ذلك ، تشارك الجينات المستجيبة لـ PPARγ أيضًا في تنظيم استقلاب الأحماض الدهنية.
مقاومة الأنسولين هي سمة شائعة تميز مرض السكري من النوع 2. وقد تبين نشاط مضاد لمرض السكر من روزيجليتازون في النماذج الحيوانية من مرض السكري من النوع 2 في الذي ارتفاع السكر في الدم و / أو ضعف تحمل الجلوكوز هو نتيجة لمقاومة الأنسولين في الهدف مناديل. Rosiglitazone يقلل من تركيزات الجلوكوز في الدم ويقلل من فرط الأنسولين في الماوس ob / ob السمنة ، db / db فأر السكري ، والفأر fa / fa Zucker fat.
في النماذج الحيوانية ، تبين أن النشاط المضاد لمرض السكر من روزيجليتازون يتوسط عن طريق زيادة الحساسية لعمل الأنسولين في الكبد والعضلات والأنسجة الدهنية. تشير الدراسات الدوائية في النماذج الحيوانية إلى أن روزيجليتازون يمنع تكوين السكر في الكبد. تمت زيادة التعبير عن ناقل الجلوكوز الذي ينظم الأنسولين GLUT-4 في الأنسجة الدهنية. لم يحفز روزيجليتازون نقص السكر في الدم في النماذج الحيوانية لمرض السكري من النوع 2 و / أو ضعف تحمل الجلوكوز.
الدوائية
لم يتم استبعاد المرضى الذين يعانون من تشوهات الدهون من التجارب السريرية ل AVANDIA.
في جميع التجارب التي استمرت لمدة 26 أسبوعًا ، عبر نطاق الجرعة الموصى به ، ارتبطت AVANDIA كعلاج وحيد بزيادة في الكوليسترول الكلي ، LDL ، و HDL وانخفاض في الأحماض الدهنية المجانية. كانت هذه التغييرات مختلفة إحصائيا بشكل كبير عن الضوابط وهمي أو glyburide (الجدول 7).
حدثت الزيادات في LDL في المقام الأول خلال أول 1-2 أشهر من العلاج مع AVANDIA وظلت مستويات LDL مرتفعة فوق خط الأساس طوال التجارب. في المقابل ، واصلت HDL في الارتفاع مع مرور الوقت. نتيجة لذلك ، بلغت نسبة LDL / HDL ذروتها بعد شهرين من العلاج ثم بدا أنها تنخفض بمرور الوقت. بسبب الطبيعة الزمنية للتغيرات الدهنية ، فإن الدراسة التي تستغرق 52 أسبوعًا والتي تسيطر عليها الغليبيريد هي الأكثر صلة بتقييم الآثار طويلة المدى على الدهون. في الأساس ، الأسبوع 26 والأسبوع 52 ، يعني أن نسب LDL / HDL كانت 3.1 ، 3.2 ، و 3.0 ، على التوالي ، ل AVANDIA 4 mg مرتين يوميًا. وكانت القيم المقابلة ل glyburide 3.2 و 3.1 و 2.9. كانت الاختلافات في التغيير من خط الأساس بين AVANDIA و glyburide في الأسبوع 52 ذات دلالة إحصائية.
نمط LDL و HDL يتغير بعد العلاج مع AVANDIA بالاقتران مع عوامل سكر الدم الأخرى كانت عمومًا مماثلة لتلك التي شوهدت مع AVANDIA في العلاج الأحادي.
كانت التغييرات في الدهون الثلاثية أثناء العلاج مع AVANDIA متغيرة وعموما لم تكن مختلفة إحصائيا من الضوابط وهمي أو glyburide.
الجدول 7. ملخص للتغييرات الدهنية المتوسطة في الدراسات التي أجريت على 26 أسبوعًا والتي خضعت للتحكم بالعلاج الغفل و 52 أسبوعًا بواسطة الغلوبريد
| وهمي تسيطر عليها الدراسات الأسبوع 26 | دراسة غلوبوريد التي تسيطر عليها الأسبوع 26 والأسبوع 52 | ||||||
| الوهمي | أفانديا | غليبوريد المعايرة | أفانديا 8 ملغ | ||||
| 4 ملغ يوميًا * | 8 ملغ يوميًا * | أسبوع 26 | أسبوع 52 | أسبوع 26 | أسبوع 52 | ||
| الأحماض الدهنية الحرة | |||||||
| ن | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| خط الأساس (الوسط)٪ | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| التغيير من خط الأساس (الوسط) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| ن | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| خط الأساس (الوسط)٪ | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| التغيير من خط الأساس (الوسط) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| ن | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| خط الأساس (الوسط)٪ | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| التغيير من خط الأساس (الوسط) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * مرة واحدة يوميا ومجموعات الجرعات اليومية مجتمعة. |
الدوائية
يزيد تركيز البلازما الأقصى (Cmax) والمنطقة الواقعة أسفل المنحنى (AUC) من روسيجليتازون بطريقة متناسبة مع الجرعة على مدى الجرعة العلاجية (الجدول 8). عمر النصف للتخلص من 3 إلى 4 ساعات ومستقل عن الجرعة.
الجدول 8. متوسط (SD) المعلمات الدوائية لل Rosiglitazone بعد الجرعات الفردية عن طريق الفم (N = 32)
| معامل | 1 ملغ الصيام | 2 ملغ الصيام | 8 ملغ الصيام | 8 مجم بنك الاحتياطي الفيدرالي |
| AUC0-inf [NG-ساعة / مل] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [نانوغرام / مل] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| نصف الحياة [ساعة] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / ساعة] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = إزالة الشفوي. |
استيعاب
التوافر الحيوي المطلق لل روزيجليتازون هو 99 ٪. ويلاحظ تركيزات البلازما الذروة حوالي 1 ساعة بعد الجرعات. لم يؤد إعطاء روزيجليتازون مع الطعام إلى أي تغيير في التعرض الكلي (AUC) ، ولكن كان هناك انخفاض بنسبة 28 ٪ تقريبًا في Cmax وتأخر في Tmax (1.75 ساعة). من غير المرجح أن تكون هذه التغييرات مهمة سريريًا ؛ لذلك ، يمكن إعطاء AVANDIA مع أو بدون طعام.
توزيع
يبلغ متوسط الحجم (CV٪) عن طريق الفم للتوزيع (Vss / F) من روزيجليتازون حوالي 17.6 (30٪) لتر ، استنادًا إلى تحليل الحرائك الدوائية للسكان. يرتبط Rosiglitazone بنسبة 99.8٪ تقريبًا ببروتينات البلازما ، وبالألبومين بشكل أساسي.
التمثيل الغذائي
يتم استقلاب روزيجليتازون على نطاق واسع دون إفراز أي دواء في البول. كانت الطرق الرئيسية لعملية التمثيل الغذائي هي إزالة الميثيل النيتروجيني والهيدروكسيل ، تليها اقتران مع الكبريتات وحمض الجلوكورونيك. جميع المستقلبات المتداولة أقل فاعلية بكثير من الأم ، وبالتالي ، لا يُتوقع أن تسهم في نشاط التوعية بالأنسولين من روزيجليتازون.
في البيانات المختبرية ، تُظهِر أن روزيجليتازون يتم استقلابه في الغالب عن طريق انزيم إنزيم Cytochrome P450 (CYP) 2C8 ، مع مساهمة CYP2C9 كطريق ثانوي.
إفراز
بعد تناوله عن طريق الفم أو عن طريق الوريد من [14C] ماليات روسيجليتازون ، تم التخلص من حوالي 64 ٪ و 23 ٪ من الجرعة في البول وفي البراز ، على التوالي. تراوحت فترة نصف عمر البلازما للمادة [14C] ذات الصلة من 103 إلى 158 ساعة.
الدوائية السكانية في المرضى الذين يعانون من مرض السكري من النوع 2
يحلل الدوائي السكان من 3 تجارب سريرية كبيرة بما في ذلك 642 من الرجال و 405 امرأة مع مرض السكري من النوع 2 (35 سنة) إلى 80 عامًا) أظهرت أن الحرائك الدوائية للـ روسيجليتازون لا تتأثر بالعمر أو العرق أو التدخين أو الكحول. استهلاك. وقد تبين أن كل من الخلوص الفموي (CL / F) وحجم التوزيع الثابت عن طريق الفم (Vss / F) يزيدان مع زيادة في وزن الجسم. على مدى الوزن الذي لوحظ في هذه التحليلات (من 50 إلى 150 كجم) ، تباين مدى قيم CL / F و Vss / F المتوقعة بنسبة <1.7 ضعفا و <2.3 ضعفا ، على التوالي.
بالإضافة إلى ذلك ، تبين أن روزيجليتازون CL / F يتأثر بالوزن والجنس على حد سواء ، كونه أقل (حوالي 15 ٪) في المرضى الإناث.
السكان الخاصة
الشيخوخة
نتائج التحليل الدوائي للسكان (ن = 716 <65 سنة ؛ ن = 331 ¥ ¥ 65 سنة) أظهرت أن العمر لا يؤثر بشكل كبير على الدوائية من روزيجليتازون.
جنس
أظهرت نتائج تحليل الحرائك الدوائية للسكان أن إزالة الخل عن طريق الفم من روسيجليتازون في كان المرضى الإناث (ن = 405) حوالي 6 ٪ أقل مقارنة مع المرضى الذكور من نفس وزن الجسم (ن = 642).
كعلاج وحيد وبالتزامن مع الميتفورمين ، حسنت AVANDIA التحكم في نسبة السكر في الدم لدى كل من الذكور والإناث. في دراسات تركيبة الميتفورمين ، أثبتت الفعالية عدم وجود فروق بين الجنسين في استجابة نسبة السكر في الدم.
في الدراسات أحادية ، لوحظ استجابة علاجية أكبر في الإناث. ومع ذلك ، في المرضى الذين يعانون من السمنة المفرطة ، كانت الفروق بين الجنسين أقل وضوحا. بالنسبة لمؤشر كتلة الجسم المعطى (BMI) ، تميل الإناث إلى الحصول على كتلة دهنية أكبر من الذكور. نظرًا لأن الهدف الجزيئي PPARγ يتم التعبير عنه في الأنسجة الدهنية ، فإن هذه الخاصية المميزة قد تفسر ، جزئيًا على الأقل ، استجابة أكبر ل AVANDIA عند الإناث. نظرًا لأن المعالجة يجب أن تكون فردية ، فلا يلزم إجراء تعديلات على الجرعة وحدها.
اختلال كبدي
كانت إزالة روسيجليتازون عن طريق الفم أقل بشكل ملحوظ في المرضى الذين يعانون من مرض الكبد معتدلة إلى حادة (تشايلد- الفئة ب / ج) مقارنة مع الأشخاص الأصحاء. نتيجة لذلك ، تمت زيادة Cmax و AUC0-inf غير المربوطة بنسبة 2 و 3 أضعاف ، على التوالي. كان عمر النصف للتخلص من روسيجليتازون حوالي ساعتين أطول في المرضى الذين يعانون من أمراض الكبد ، مقارنة بالأشخاص الأصحاء.
لا ينبغي بدء العلاج باستخدام AVANDIA إذا أظهر المريض أدلة سريرية على نشاطه مرض الكبد أو زيادة مستويات الترانساميناز في المصل (ALT> 2.5X الحد العلوي الطبيعي) في الأساس [نرى المحاذير والإحتياطات].
اخصائي اطفال
تم إنشاء المعلمات الدوائية من روزيجليتازون في مرضى الأطفال باستخدام تحليل الحرائك السكانية مع بيانات متفرق من 96 مرضى الأطفال في تجربة سريرية لطب الأطفال تضم 33 ذكور و 63 إناث تتراوح أعمارهم بين 10 و 17 عامًا (تتراوح أوزانهم من 35 إلى 178.3 كجم). كان متوسط عدد السكان CL / F و V / F من روسيجليتازون 3.15 لتر / ساعة و 13.5 لتر ، على التوالي. كانت هذه تقديرات CL / F و V / F متسقة مع تقديرات المعلمة النموذجية من تحليل السكان البالغين السابقة.
القصور الكلوي
لا توجد فروق ذات صلة سريريًا في الحرائك الدوائية للـ روسيجليتازون في المرضى الذين يعانون من خفيفة إلى القصور الكلوي الحاد أو في المرضى الذين يعتمدون على غسيل الكلى مقارنة مع الأشخاص الذين يعانون من الكلى الطبيعي وظيفة. لذلك لا يلزم تعديل الجرعة في هؤلاء المرضى الذين يتلقون AVANDIA. منذ بطلان الميتفورمين في المرضى الذين يعانون من القصور الكلوي ، هو بطلان الترافق بين الميتفورمين مع AVANDIA في هؤلاء المرضى.
سباق
تشير نتائج تحليل الحرائك الدوائية للسكان ، بما في ذلك موضوعات الأصول القوقازية والسوداء وغيرها من الأصول العرقية ، إلى أن العرق ليس له أي تأثير على الحرائك الدوائية للروسيجليتازون.
المخدرات المخدرات التفاعلات
الأدوية التي تمنع أو تحفز أو تستقلب بواسطة Cytochrome P450
في دراسات استقلاب المخدرات في المختبر تشير إلى أن روزيجليتازون لا يمنع أي من إنزيمات P450 الرئيسية بتركيزات ذات صلة سريريًا. في المختبر ، تظهر البيانات أن روزيجليتازون يتم استقلابه في الغالب بواسطة CYP2C8 ، وبدرجة أقل ، 2C9. وقد تبين أن AVANDIA (4 ملغ مرتين يوميًا) ليس له أي تأثير ذي صلة سريريًا على الحرائك الدوائية لـ نيفيديبين ووسائل منع الحمل عن طريق الفم (إيثينيل استراديول ونوريثيندرون) ، والتي يتم استقلابها في الغالب بواسطة CYP3A4.
جمفبروزيل
الإدارة المصاحبة لجيمفيبروزيل (600 ملغ مرتين يوميًا) ، مثبط CYP2C8 ، و روزيجليتازون (4 ملغ مرة واحدة يوميًا) لمدة 7 أيام زادت روزيجليتازون AUC بنسبة 127٪ ، مقارنة بإعطاء روزيجليتازون (4 ملغ مرة واحدة يوميًا) وحده. بالنظر إلى احتمالية وقوع أحداث ضارة مرتبطة بالجرعة مع روزيجليتازون ، فقد تكون هناك حاجة إلى انخفاض في جرعة روزيجليتازون عند إدخال الجيمفيبروزيل [انظر تفاعل الأدوية].
ريفامبين
تشير التقارير إلى أن تناول عقار ريفامبين (600 ملغ مرة واحدة في اليوم) ، وهو محفز لـ CYP2C8 ، لمدة 6 أيام يقلل من روزيجليتازون AUC بنسبة 66 ٪ ، مقارنة بإعطاء روزيجليتازون (8 ملغ) وحده [انظر تفاعل الأدوية].4
غليبوريد
لم يتغير AVANDIA (2 ملغ مرتين يوميًا) بالتزامن مع الغليبيريد (3.75 إلى 10 ملغ / يوم) لمدة 7 أيام استقر متوسط تركيزات الجلوكوز في البلازما لمدة 24 ساعة في مرضى السكري على الغليبيريد علاج نفسي. تسببت جرعات متكررة من AVANDIA (8 ملغ مرة واحدة يوميًا) لمدة 8 أيام في الأشخاص القوقازيين البالغين الأصحاء في انخفاض في الجليبيريد AUC و Cmax بحوالي 30٪. في المواد اليابانية ، زاد glyburide AUC و Cmax بشكل طفيف بعد التناول المتزامن لـ AVANDIA.
غليميبيريد
لم يكن للجرعات الفموية الوحيدة من الجليميبيريد في 14 من الأشخاص البالغين الأصحاء أي تأثير كبير سريريًا على الحرائك الدوائية ذات الحالة الثابتة لـ AVANDIA. لا تخفيضات كبيرة سريريا في جليمبيريد AUC و Cماكس لوحظت بعد تكرار جرعات من AVANDIA (8 ملغ مرة واحدة يوميًا) لمدة 8 أيام في الأشخاص البالغين الأصحاء.
ميتفورمين
إدارة المتزامنة من AVANDIA (2 ملغ مرتين يوميا) والميتفورمين (500 ملغ مرتين يوميا) في صحة جيدة لم يكن للمتطوعين لمدة 4 أيام أي تأثير على الحرائك الدوائية المستقرة لأي من الميتفورمين أو روزيجليتازون.
اكاربوسي
لم يكن لإدماج أكاربوز (100 ملغ ثلاث مرات يوميًا) لمدة 7 أيام في متطوعين أصحاء أي تأثير سريريًا على الحرائك الدوائية لجرعة واحدة عن طريق الفم من AVANDIA.
الديجوكسين
تكرار الجرعات عن طريق الفم من AVANDIA (8 ملغ مرة واحدة يوميًا) لمدة 14 يومًا لم يغير الدوائية الحالة المستقرة للديجوكسين (0.375 ملغ مرة واحدة يوميًا) في المتطوعين الأصحاء.
الوارفارين
لم يكن لتكرار الجرعات باستخدام AVANDIA أي تأثير ذي صلة سريريًا على الحرائك الدوائية ذات الحالة الثابتة لمصانع الوارفارين.
الإيثانول
لم يؤد تناول جرعة واحدة معتدلة من الكحول إلى زيادة خطر الإصابة بنقص السكر في الدم الحاد في مرضى السكري من النوع 2 الذين عولجوا ب AVANDIA.
رانيتيدين
لم يغير العلاج بالرانيتيدين (150 ملغ مرتين يوميًا لمدة 4 أيام) من الدوائية إما جرعات عن طريق الفم أو عن طريق الوريد من روزيجليتازون في المتطوعين الأصحاء.
هذه النتائج تشير إلى أن امتصاص روزيجليتازون عن طريق الفم لا يتغير في الظروف المصحوبة بزيادة في درجة الحموضة المعوية.
أعلى
علم السموم غير الإكلينيكي
التسرطن ، الطفرات ، ضعف الخصوبة
التسرطن:
أجريت دراسة سرطانية مدتها سنتان في فئران نهر تشارلز CD-1 بجرعات 0.4 و 1.5 و 6 مغ / كغ / يوم في النظام الغذائي (أعلى جرعة تعادل ما يقرب من 12 مرة من AUC الإنسان في أقصى الإنسان الموصى بها يوميا جرعة). تم جرعات الفئران Sprague-Dawley لمدة عامين عن طريق الفم عن طريق الفم بجرعات 0.05 ، 0.3 ، و 2 مجم / كجم / يوم (أعلى جرعة تعادل إلى ما يقرب من 10 و 20 مرة من AUC البشري في الحد الأقصى الجرعة اليومية الموصى بها الإنسان للذكور والإناث الفئران ، على التوالي).
لم يكن Rosiglitazone مسرطناً في الماوس. كانت هناك زيادة في حالات تضخم الدهون الشحمية في الفأر بجرعات 1.5 ملغ / كغ / يوم (حوالي 2 أضعاف إنسان عند الحد الأقصى الموصى به من الجرعة اليومية البشرية). في الفئران ، كانت هناك زيادة كبيرة في حدوث أورام الأنسجة الدهنية الحميدة (الأورام الشحمية) بجرعات 0.3 ملغ / كغ / يوم (حوالي 2 مرات AUC الإنسان في الحد الأقصى الجرعة اليومية البشرية الموصى بها). وتعتبر هذه التغييرات التكاثري في كلا النوعين بسبب الإفراط في التحفيز الدوائي للأنسجة الدهنية.
الطفرات:
لم يكن روسيجليتازون مُطفِرًا أو مُمْرِضًا في المقايسات البكتيرية في المختبر من أجل طفرة جينية ، في المختبر اختبار انحراف الكروموسوم في الخلايا اللمفاوية البشرية ، واختبار النواة الصغيرة في الجسم الحي ، واختبار الجرذان في الجسم الحي / في المختبر فحص. كانت هناك زيادة صغيرة (حوالي 2 أضعاف) في طفرة في فحص سرطان الغدد الليمفاوية في المختبر في وجود تفعيل التمثيل الغذائي.
ضعف الخصوبة:
لم يكن لل Rosiglitazone أي تأثير على تزاوج أو خصوبة الفئران الذكور التي أعطيت ما يصل إلى 40 مغ / كغ / يوم (ما يقرب من 116 مرة من الجرعة البشرية عند الحد الأقصى الموصى به من الجرعة اليومية البشرية). روزيجليتازون غيرت الدورة الشهرية النيزكية (2 مغ / كغ / يوم) وانخفاض الخصوبة (40 ملغ / كغ / يوم) من الفئران الإناث بالتعاون مع انخفاض مستويات البلازما من هرمون البروجسترون والإستراديول (حوالي 20 و 200 مرة من جسم الإنسان في الجسم عند الحد الأقصى الموصى به من الجرعة اليومية البشرية ، على التوالي). لم تلاحظ أي آثار من هذا القبيل عند 0.2 ملغ / كغ / يوم (حوالي 3 مرات من الجين AUC البشري عند الحد الأقصى الموصى به من الجرعة اليومية البشرية). في جرذان الأحداث الذين تتراوح أعمارهم بين 27 يومًا وحتى مرحلة النضج الجنسي (حتى 40 ملغ / كغ / يوم) ، لم يكن هناك أي تأثير على الأداء التناسلي للذكور ، أو على النتوء الشبق أو أداء التزاوج أو حالات الحمل عند الإناث (حوالي 68 مرة من إصابة الإنسان في الجسم عند الحد الأقصى الموصى به يوميًا للبشر جرعة). في القرود ، روسيجليتازون (0.6 و 4.6 ملغم / كغم / يوم ؛ ما يقرب من 3 و 15 مرة من AUC الإنسان في الحد الأقصى الجرعة اليومية الموصى بها الإنسان ، على التوالي) قللت من ارتفاع المرحلة مسامي في استراديول المصل مع ما يترتب على ذلك من انخفاض في هرمون لوتين ، وانخفاض مستويات هرمون البروجسترون المرحلة الصفراء ، و انقطاع الطمث. يبدو أن آلية هذه التأثيرات تثبيط مباشر لستيرويد المبيض.
علم السموم الحيوانية
تم زيادة أوزان القلب في الفئران (3 ملغ / كلغ / يوم) ، الفئران (5 ملغ / كلغ / يوم) ، والكلاب (2 ملغ / كلغ / يوم) مع روسيجليتازون العلاجات (حوالي 5 ، 22 ، و 2 مرات AUC الإنسان في أقصى جرعة يومية الموصى بها الإنسان ، على التوالي). كانت آثار الفئران الأحداث متسقة مع تلك التي شوهدت عند البالغين. أشار القياس المورفومتري إلى وجود تضخم في أنسجة البطين القلبي ، والتي قد تكون ناجمة عن زيادة عمل القلب نتيجة لتوسع حجم البلازما.
أعلى
الدراسات السريرية
وحيد
في الدراسات السريرية ، أدى العلاج بـ AVANDIA إلى تحسن في السيطرة على نسبة السكر في الدم ، كما تم قياسه بواسطة FPG و HbA1c ، مع انخفاض متزامن في الأنسولين والببتيد C. كما تم تخفيض الجلوكوز والأنسولين بعد الأكل. هذا يتفق مع آلية عمل AVANDIA كمحسس للأنسولين.
الحد الأقصى الموصى به الجرعة اليومية 8 ملغ. اقترحت الدراسات التي تتراوح بين الجرعة أنه لم يتم الحصول على فائدة إضافية مع جرعة يومية مجموعها 12 ملغ.
الدراسات السريرية قصيرة الأجل: تم علاج ما مجموعه 2،315 من مرضى السكري من النوع 2 ، الذين سبق علاجهم بالنظام الغذائي وحده أو الأدوية المضادة لمرض السكر ، مع AVANDIA كعلاج وحيد في 6 مرضى التعمية الدراسات ، التي شملت دراستين هيمنتان على مدى 26 أسبوعًا ، ودراسة واحدة لمدة 52 أسبوعًا يتم التحكم فيها بواسطة الغليبيريد ، و 3 دراسات على مدى الجرعة المضبوطة بالغفل لمدة 8 إلى 12 أسبوعًا. تم سحب الأدوية (الأدوية) السابقة المضادة لمرض السكر ، ودخل المرضى فترة تشغيل وهمي من 2 إلى 4 أسابيع قبل التوزيع العشوائي.
تجربتان لمدة 26 أسبوعًا ، مزدوجة التعمية ، خاضعة للتحكم الوهمي ، في المرضى الذين يعانون من داء السكري من النوع 2 (ن = 1401) مع نسبة السكر في الدم غير كافية كان التحكم (متوسط خط الأساس FPG حوالي 228 مجم / ديسيلتر [101 إلى 425 ملغ / ديسيلتر] وخط الأساس لنسبة HbA1c 8.9 ٪ [5.2 ٪ إلى 16.2 ٪]) ، أدى إلى. أنتجت المعاملة مع AVANDIA تحسينات ذات دلالة إحصائية في FPG و HbA1c مقارنة مع خط الأساس ونسب وهمي. تم تلخيص البيانات من إحدى هذه الدراسات في الجدول 9.
الجدول 9: معلمات نسبة السكر في الدم في محاكمة تسيطر عليها وهمي لمدة 26 أسبوعا
| الوهمي ن = 173 |
أفانديا | أفانديا | |||
| 4 ملغ مرة واحدة يوميًا ن = 180 |
2 ملغ مرتين يوميا العدد = 186 |
8 ملغ مرة واحدة يوميا العدد = 181 |
4 ملغ مرتين يوميًا العدد = 187 |
||
| FPG (mg / dL) | |||||
| خط الأساس (الوسط) | 225 | 229 | 225 | 228 | 228 |
| التغيير من خط الأساس (الوسط) | 8 | -25 | -35 | -42 | -55 |
| الفرق من الدواء الوهمي (المعدل المعدل) | - | -31* | -43* | -49* | -62* |
| ٪ من المرضى الذين يعانون من انخفاض 30 ملغ / ديسيلتر من الأساس | 19% | 45% | 54% | 58% | 70% |
| HbA1c (٪) | |||||
| خط الأساس (الوسط) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| التغيير من خط الأساس (الوسط) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| الفرق من الدواء الوهمي (المعدل المعدل) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| ٪ من المرضى الذين يعانون من انخفاض 0.7 ٪ من خط الأساس | 9% | 28% | 29% | 39% | 54% |
| * ع <0.0001 مقارنة مع الدواء الوهمي. |
عند تناوله بنفس الجرعة اليومية الكلية ، كان AVANDIA بشكل عام أكثر فاعلية في تقليل FPG و HbA1c عند تناوله في جرعات مقسمة مرتين يوميًا مقارنة بجرعات يومية واحدة. ومع ذلك ، بالنسبة لـ HbA1c ، فإن الفرق بين 4 ملغ مرة واحدة يوميًا و 2 ملغ مرتين يوميًا لم يكن مهمًا من الناحية الإحصائية.
الدراسات السريرية طويلة الأجل
تم تقييم الحفاظ على المدى الطويل من تأثير في 52 أسبوعا ، مزدوجة التعمية ، التي تسيطر عليها غليبيريد محاكمة في المرضى الذين يعانون من مرض السكري من النوع 2. تم اختيارهم بصورة عشوائية من المرضى للعلاج مع AVANDIA 2 ملغ مرتين يوميا (N = 195) أو AVANDIA 4 ملغ مرتين يوميا (N = 189) أو glyburide (N = 202) لمدة 52 أسبوعا. أعطيت المرضى الذين يتلقون الجليبريد جرعة أولية إما 2.5 ملغ / يوم أو 5.0 ملغ / يوم. بعد ذلك ، تم معايرة الجرعة بزيادات مقدارها 2.5 ملغ / يوم خلال الأسابيع الـ 12 التالية ، بحد أقصى 15.0 ملغ / يوم من أجل تحسين السيطرة على نسبة السكر في الدم. بعد ذلك ، تم الاحتفاظ جرعة غليبوريد ثابت.
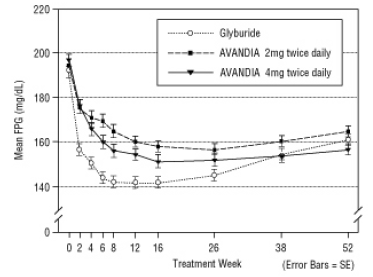
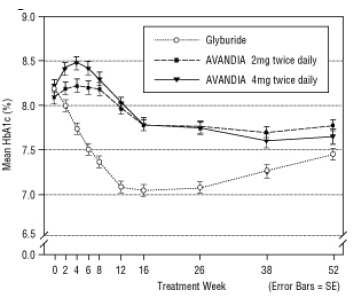
كانت الجرعة المتوسطة المعايرة من الغليبيريد 7.5 ملغ. أسفرت جميع العلاجات في تحسن كبير إحصائيا في السيطرة على نسبة السكر في الدم من الأساس (الشكل 4 والشكل 5). في نهاية الأسبوع 52 ، كان التخفيض من خط الأساس في FPG و HbA1c -40.8 ملغ / دل و -0.53 ٪ مع AVANDIA 4 ملغ مرتين يوميًا ؛ -25.4 ملغ / ديسيلتر و -0.27٪ مع أفانديا 2 ملغ مرتين يوميًا ؛ و -30.0 ملغ / ديسيلتر و -0.72 ٪ مع الغليبيريد. بالنسبة لـ HbA1c ، لم يكن الفرق بين AVANDIA 4 mg مرتين يوميًا و glyburide كبيرًا من الناحية الإحصائية في الأسبوع 52. كان الانخفاض الأولي في FPG مع glyburide أكبر منه مع AVANDIA ؛ ومع ذلك ، كان هذا التأثير أقل دواما مع مرور الوقت.
تم الحفاظ على التحسن في نسبة السكر في الدم المرئي مع AVANDIA 4 ملغ مرتين يوميًا في الأسبوع 26 خلال الأسبوع 52 من الدراسة.
الشكل 4. يعني FPG مع مرور الوقت في دراسة لمدة 52 أسبوعا التي تسيطر عليها غليبوريد
الشكل 5. يعني HbA1c مع مرور الوقت في دراسة لمدة 52 أسبوعا التي تسيطر عليها غليبوريد
تم الإبلاغ عن نقص السكر في الدم في 12.1 ٪ من المرضى المعالجين بالجليبورايد مقابل 0.5 ٪ (2 ملغ مرتين يوميا) و 1.6 ٪ (4 ملغ مرتين يوميا) من المرضى الذين عولجوا مع AVANDIA. وارتبطت التحسينات في السيطرة على نسبة السكر في الدم مع زيادة الوزن يعني 1.75 كجم و 2.95 كجم ل المرضى الذين عولجوا 2 ملغ و 4 ملغ مرتين يوميًا من AVANDIA ، على التوالي ، مقابل 1.9 كجم في علاج الغليبيريد المرضى. في المرضى الذين عولجوا مع AVANDIA ، كانت منتجات C- الببتيد ، الأنسولين ، المؤيد للأنسولين ، والموزعة على الأنسولين انخفاض كبير بطريقة الجرعة المطلوبة ، مقارنة مع زيادة في علاج الغليبيريد المرضى.
كانت تجربة تقدم نتائج مرض السكري (ADOPT) تجربة متعددة المراكز ، مزدوجة التعمية ، محكومة (N = 4،351) أجريت على مدى 4 إلى 6 سنوات لمقارنة السلامة والفعالية مرضى AVANDIA ، الميتفورمين ، و glyburide في المرضى الذين تم تشخيصهم مؤخرًا بمرض السكري من النوع 2 (حوالي 3 سنوات) غير خاضع للرقابة الكافية مع النظام الغذائي و ممارسه الرياضه. كان متوسط عمر المرضى في هذه التجربة 57 عامًا ، ولم يكن لدى غالبية المرضى (83٪) أي تاريخ معروف لمرض القلب والأوعية الدموية. وكان متوسط خط الأساس FPG و HbA1c 152 ملغ / دل و 7.4 ٪ ، على التوالي. تم اختيار المرضى بشكل عشوائي لتلقي إما أفانديا 4 ملغ مرة واحدة يوميًا ، غليبيريد 2.5 ملغ مرة واحدة يوميًا ، أو ميتفورمين 500 ملغ مرة واحدة يوميًا ، وكانت الجرعات معايرة للتحكم الأمثل في نسبة السكر في الدم بحد أقصى 4 ملغ مرتين يوميًا لـ AVANDIA ، و 7.5 مجم مرتين يوميًا للجليبريد ، و 1000 مجم مرتين يوميًا الميتفورمين. كانت نتيجة الفعالية الأولية هي الوقت الذي استغرقته FPG متتالية> 180 ملغ / ديسيلتر بعد 6 أسابيع على الأقل من العلاج بحد أقصى جرعة متسامحة من دراسة الدواء أو الوقت لعدم كفاية السيطرة على نسبة السكر في الدم ، على النحو الذي يحدده حكم مستقل اللجنة.
كان معدل التراكمي لنتائج الفعالية الأولية في 5 سنوات 15 ٪ مع AVANDIA ، 21 ٪ مع الميتفورمين ، و 34 ٪ مع glyburide (نسبة الخطر 0.68 [95٪ CI 0.55 ، 0.85] مقابل الميتفورمين ، HR 0.37 [95٪ CI 0.30 ، 0.45] مقابل glyburide).
تم وصف بيانات الأحداث القلبية الوعائية والضارة (بما في ذلك التأثيرات على وزن الجسم وكسر العظام) من ADOPT لـ AVANDIA والميتفورمين والجليبريد في المحاذير والإحتياطات و ردود الفعل الضارة، على التوالي. كما هو الحال مع جميع الأدوية ، يجب النظر في نتائج الفعالية جنبًا إلى جنب مع معلومات السلامة لتقييم الفوائد والمخاطر المحتملة لمريض فردي.
مزيج مع الميتفورمين أو السلفونيل يوريا
أدت إضافة AVANDIA إلى الميتفورمين أو السلفونيل يوريا إلى انخفاض كبير في ارتفاع السكر في الدم مقارنة بأي من هذه العوامل وحدها. تتوافق هذه النتائج مع وجود تأثير إضافي على التحكم في نسبة السكر في الدم عند استخدام AVANDIA كعلاج مركب.
مزيج مع الميتفورمين
شارك ما مجموعه 670 مريضًا من داء السكري من النوع 2 في اثنين من 26 أسبوعًا ، عشوائيًا ، مزدوج التعمية ، وهمي / الدراسات التي تسيطر عليها النشطة تهدف إلى تقييم فعالية AVANDIA في تركيبة مع الميتفورمين. تمت إضافة AVANDIA ، التي يتم إعطاؤها إما مرة واحدة يوميًا أو مرتين يوميًا ، إلى علاج الجرعات التي لم يتم التحكم فيها بشكل كافٍ بجرعة قصوى (2.5 جرام / يوم) من الميتفورمين.
في إحدى الدراسات ، خضع المرضى لرقابة غير كافية على 2.5 غرام / يوم من الميتفورمين (متوسط خط الأساس FPG 216 ملغ / دل وخط الأساس المتوسط تم اختيارهم بصورة عشوائية HbA1c 8.8 ٪) لتلقي 4 ملغ من AVANDIA مرة واحدة يوميا ، 8 ملغ من AVANDIA مرة واحدة يوميا ، أو وهمي بالإضافة إلى الميتفورمين. وقد لوحظ تحسن كبير إحصائيا في FPG و HbA1c في المرضى الذين عولجوا مع مجموعات من الميتفورمين و 4 ملغ من أفانديا مرة واحدة يوميًا و 8 ملغ من أفانديا مرة واحدة يوميًا ، مقابل المرضى استمروا في الميتفورمين وحده (الجدول 10).
الجدول 10. معلمات نسبة السكر في الدم في دراسة مزيج لمدة 26 أسبوعا من AVANDIA Plus Metformin
| ميتفورمين العدد = 113 |
أفانديا 4 ملغ مرة واحدة يوميا + الميتفورمين العدد = 116 |
أفانديا 8 ملغ مرة واحدة يوميا + الميتفورمين ن = 110 |
|
| FPG (mg / dL) | |||
| خط الأساس (الوسط) | 214 | 215 | 220 |
| التغيير من خط الأساس (الوسط) | 6 | -33 | -48 |
| الفرق من الميتفورمين وحده (الوسط المعدل) | - | -40* | -53* |
| ٪ من المرضى الذين يعانون من انخفاض 30 ملغ / ديسيلتر من الأساس | 20% | 45% | 61% |
| HbA1c (٪) | |||
| خط الأساس (الوسط) | 8.6 | 8.9 | 8.9 |
| التغيير من خط الأساس (الوسط) | 0.5 | -0.6 | -0.8 |
| الفرق من الميتفورمين وحده (الوسط المعدل) | - | -1.0* | -1.2* |
| ٪ من المرضى الذين يعانون من انخفاض 0.7 ٪ من خط الأساس | 11% | 45% | 52% |
| * ع <0.0001 مقارنة مع الميتفورمين. |
في دراسة ثانية مدتها 26 أسبوعًا ، لم يتم التحكم بشكل كافٍ في مرضى السكري من النوع 2 على 2.5 جرام / يوم من الميتفورمين الذين تم اختيارهم بصورة عشوائية لتلقي مزيج من AVANDIA 4 ملغ مرتين يوميًا و أظهر الميتفورمين (N = 105) تحسنا ملحوظا إحصائيا في السيطرة على نسبة السكر في الدم مع تأثير العلاج يعني FPG من -56 ملغ / دل وتأثير علاج يعني ل HbA1c من -0.8 ٪ أكثر من الميتفورمين وحده. أدى مزيج الميتفورمين و AVANDIA إلى انخفاض مستويات FPG و HbA1c عن أي من الوكلاء وحدهما.
المرضى الذين لم يسيطروا بشكل كاف على جرعة قصوى (2.5 غرام / يوم) من الميتفورمين والذين كانوا تحولت إلى أحادي مع AVANDIA أظهرت فقدان السيطرة على نسبة السكر في الدم ، كما يتضح من الزيادات في FPG و HbA1c. في هذه المجموعة ، شوهدت زيادات في LDL و VLDL أيضًا.
مع مزيج السلفونيل يوريا
شارك ما مجموعه 3،457 مريضًا من داء السكري من النوع 2 في عشر دراسات عشوائية ، مزدوجة التعمية ، وهمي / نشط تسيطر عليها من 24 إلى 26 أسبوعًا ، ودراسة واحدة دراسة لمدة عامين مزدوجة التعمية والتحكم النشط في المرضى المسنين تهدف إلى تقييم فعالية وسلامة AVANDIA بالاشتراك مع السلفونيل يوريا. كانت تدار AVANDIA 2 ملغ ، 4 ملغ ، أو 8 ملغ يوميا ، إما مرة واحدة يوميا (3 دراسات) أو في جرعات مقسمة مرتين يوميًا (7 دراسات) ، للمرضى الذين لا يتحكمون بشكل كافٍ في جرعة أقل أو أقل من السلفونيل يوريا.
في هذه الدراسات ، مزيج من AVANDIA 4 ملغ أو 8 ملغ يوميا (تدار كجرعات مقسمة واحدة أو مرتين يوميا) و السلفونيل يوريا خفضت بشكل كبير FPG و HbA1c مقارنة مع الدواء الوهمي بالإضافة إلى السلفونيل يوريا أو زيادة معايرة السلفونيل يوريا. يوضح الجدول 11 البيانات المجمعة لـ 8 دراسات تم فيها مقارنة AVANDIA بالسلفونيل يوريا مع العقار الوهمي زائد السلفونيل يوريا.
الجدول 11. معلمات نسبة السكر في الدم في الدراسات المختلطة من 24 إلى 26 أسبوعًا لـ AVANDIA Plus Sulfonylurea
| مرتين يوميا مقسمة الجرعات (5 دراسات) | السلفونيل يوريا العدد = 397 |
أفانديا 2 ملغ مرتين يوميا + السلفونيل يوريا العدد = 497 |
السلفونيل يوريا العدد = 248 |
أفانديا 4 ملغ مرتين يوميًا + سلفونيل يوريا العدد = 346 |
| FPG (mg / dL) | ||||
| خط الأساس (الوسط) | 204 | 198 | 188 | 187 |
| التغيير من خط الأساس (الوسط) | 11 | -29 | 8 | -43 |
| الفرق من السلفونيل يوريا وحده (المعدل المعدل) | - | -42* | - | -53* |
| ٪ من المرضى الذين يعانون من انخفاض 30 ملغ / ديسيلتر من الأساس | 17% | 49% | 15% | 61% |
| HbA1c (٪) | ||||
| خط الأساس (الوسط) | 9.4 | 9.5 | 9.3 | 9.6 |
| التغيير من خط الأساس (الوسط) | 0.2 | -1.0 | 0.0 | -1.6 |
| الفرق من السلفونيل يوريا وحده (المعدل المعدل) | - | -1.1* | - | -1.4* |
| ٪ من المرضى الذين يعانون من انخفاض 0.7 ٪ من خط الأساس | 21% | 60% | 23% | 75% |
| مرة واحدة الجرعات اليومية (3 دراسات) | السلفونيل يوريا ن = 172 |
أفانديا 4 ملغ مرة واحدة يوميًا + سلفونيل يوريا ن = 172 |
السلفونيل يوريا ن = 173 |
أفانديا 8 ملغ مرة واحدة يوميًا + سلفونيل يوريا ن = 176 |
| FPG (mg / dL) | ||||
| خط الأساس (الوسط) | 198 | 206 | 188 | 192 |
| التغيير من خط الأساس (الوسط) | 17 | -25 | 17 | -43 |
| الفرق من السلفونيل يوريا وحده (المعدل المعدل) | - | -47* | - | -66* |
| ٪ من المرضى الذين يعانون من انخفاض 30 ملغ / ديسيلتر من الأساس | 17% | 48% | 19% | 55% |
| HbA1c (٪) | ||||
| خط الأساس (الوسط) | 8.6 | 8.8 | 8.9 | 8.9 |
| التغيير من خط الأساس (الوسط) | 0.4 | -0.5 | 0.1 | -1.2 |
| الفرق من السلفونيل يوريا وحده (المعدل المعدل) | - | -0.9* | - | -1.4* |
| ٪ من المرضى الذين يعانون من انخفاض 0.7 ٪ من خط الأساس | 11% | 36% | 20% | 68% |
| * ع <0.0001 مقارنة مع السلفونيل يوريا وحدها. |
تضمنت إحدى الدراسات التي استمرت من 24 إلى 26 أسبوعًا المرضى الذين لم يتم التحكم بهم بشكل كافٍ على جرعات الحد الأقصى من الغليبيريد وتحويلهم إلى 4 ملغ من AVANDIA يوميًا كعلاج وحيد ؛ في هذه المجموعة ، تم توضيح فقدان التحكم في نسبة السكر في الدم ، كما يتضح من الزيادات في FPG و HbA1c.
في دراسة مزدوجة التعمية استمرت عامين ، تم اختيارهم بصورة عشوائية المرضى المسنين (الذين تتراوح أعمارهم بين 59 إلى 89 سنة) على السلفونيل يوريا نصف القصوى (glipizide 10 ملغ مرتين يوميا) ل إضافة AVANDIA (ن = 115 ، 4 ملغ مرة واحدة يوميًا إلى 8 ملغ حسب الحاجة) أو لاستمرار معايرة glipizide (ن = 110) ، بحد أقصى 20 ملغ مرتين اليومي. كان متوسط خط الأساس FPG و HbA1c 157 mg / dL و 7.72٪ ، على التوالي ، لذراع AVANDIA plus glipizide و 159 mg / dL و 7.65٪ ، على التوالي ، لذراع معايرة glipizide. حدث فقدان السيطرة على نسبة السكر في الدم (FPG â ‰ ¥ 180 ملغ / ديسيلتر) في نسبة أقل بكثير من المرضى (2 ٪) على AVANDIA plus glipizide مقارنة مع المرضى في ذراع معايرة glipizide (28.7 ٪). أكمل حوالي 78 ٪ من المرضى الذين يتلقون العلاج المركب سنتين من العلاج بينما أكمل 51 ٪ فقط من العلاج أحادي glipizide. كان تأثير العلاج المركب على FPG و HbA1c دائمًا خلال فترة الدراسة التي استمرت عامين ، مع المرضى تحقيق متوسط 132 ملغ / ديسيلتر لكل من FPG وبمتوسط 6.98 ٪ لـ HbA1c مقارنة بعدم حدوث أي تغيير على glipizide ذراع.
مع مزيج السلفونيل يوريا زائد الميتفورمين
في دراستين من 24 إلى 26 أسبوعًا ، تم إجراء دراسات مزدوجة التعمية وتسيطر عليها وهمي ، لتقييم فعالية وسلامة AVANDIA مع السلفونيل يوريا بالإضافة إلى الميتفورمين ، AVANDIA 4 ملغ أو 8 ملغ يوميا ، كانت تدار في جرعات مقسمة مرتين يوميا ، للمرضى غير خاضعة للرقابة بشكل كاف على جرعات (10 ملغ) والحد الأقصى (20 ملغ) من glyburide والجرعة القصوى من الميتفورمين (2 غ / يوم). وقد لوحظ تحسن كبير إحصائيا في FPG و HbA1c في المرضى الذين عولجوا مع مزيج من السلفونيل يوريا واصلت الميتفورمين زائد و 4 ملغ من AVANDIA و 8 ملغ من AVANDIA مقابل المرضى على السلفونيل يوريا بالإضافة إلى الميتفورمين ، كما هو مبين في الجدول 12.
الجدول 12. معلمات نسبة السكر في الدم في دراسة مدتها 26 أسبوعًا لـ AVANDIA Plus Sulfonylurea و Metformin
| سلفونيلوريا + ميتفورمين ن = 273 |
أفانديا 2 ملغ مرتين يوميا + سلفونيلوريا + ميتفورمين ن = 276 |
أفانديا 4 ملغ مرتين يوميًا + سلفونيلوريا + ميتفورمين العدد = 277 |
|
| FPG (mg / dL) | |||
| خط الأساس (الوسط) | 189 | 190 | 192 |
| التغيير من خط الأساس (الوسط) | 14 | -19 | -40 |
| الفرق من السلفونيل يوريا زائد الميتفورمين (المعدل المعدل) | - | -30* | -52* |
| ٪ من المرضى الذين يعانون من انخفاض 30 ملغ / ديسيلتر من الأساس | 16% | 46% | 62% |
| HbA1c (٪) | |||
| خط الأساس (الوسط) | 8.7 | 8.6 | 8.7 |
| التغيير من خط الأساس (الوسط) | 0.2 | -0.4 | -0.9 |
| الفرق من السلفونيل يوريا زائد الميتفورمين (المعدل المعدل) | - | -0.6* | -1.1* |
| ٪ من المرضى الذين يعانون من انخفاض 0.7 ٪ من خط الأساس | 16% | 39% | 63% |
| * ع <0.0001 مقارنة مع الدواء الوهمي. |
أعلى
المراجع
- وثيقة إحاطة إدارة الغذاء والدواء. الاجتماع المشترك للجان الاستشارية للغدد الصماء للأدوية وسلامة الأدوية وإدارة المخاطر. جو 2007.
- المحققون دريم التجريبية. تأثير روزيجليتازون على تواتر مرض السكري مع ضعف تحمل الجلوكوز أو ضعف جلوكوز الصيام: تحكم عشوائي مشرط 2006;368:1096-1105.
- Home PD، Pocock SJ، Beck-Nielsen H، et al. تقييم Rosiglitazone لنتائج cardiovas - تحليل مؤقت. NEJM 2007 ؛ 357: 1-11.
- Park JY، Kim KA، Kang MH، et al. تأثير ريفامبين على الدوائية من روزيجليتازون في الأشخاص الأصحاء. Clin Pharmacol Ther 2004؛ 75: 157-162.
أعلى
كيف زودت / التخزين والمناولة
يحتوي كل قرص TILTAB مغلف بطبقة خماسية على روزيجليتازون كما هو ماليات كما يلي: 2 ملغ ، مزهر مع SB على جانب واحد و 2 على الجانب الآخر ؛ 4 ملغ-برتقالي ، مزهر مع SB على جانب و 4 من الجانب الآخر ؛ 8 ملغ-الأحمر والبني ، debossed مع SB من جانب و 8 من جهة أخرى.
- 2 ملغ زجاجات من 60: NDC 0029-3158-18
- زجاجات 4 ملغ من 30: NDC 0029-3159-13
- زجاجات 4 ملغ من 90: NDC 0029-3159-00
- زجاجات 8 ملغ من 30: NDC 0029-3160-13
- زجاجات 8 ملغ من 90: NDC 0029-3160-59
متجر في 25 درجة مئوية (77 درجة فهرنهايت) ؛ الرحلات 15 إلى 30 مئوية (59 إلى 86 فهرنهايت). ابعده عن الضغط، العلبة مقاومة للضوء.
آخر تحديث 02/2008
أفانديا ، روسيجليتازون ماليات ، معلومات المريض (في سهل الانجليزية)
معلومات مفصلة عن العلامات والأعراض والأسباب والعلاج من مرض السكري
لا تهدف المعلومات الواردة في هذه الدراسة إلى تغطية جميع الاستخدامات أو الاتجاهات أو الاحتياطات الممكنة أو التفاعلات الدوائية أو الآثار الضارة. هذه المعلومات معممة ولا تهدف إلى تقديم المشورة الطبية المحددة. إذا كانت لديك أسئلة حول الأدوية التي تتناولها أو ترغب في مزيد من المعلومات ، فاستشر طبيبك أو الصيدلي أو الممرض.
ارجع الى:تصفح جميع الأدوية لمرض السكري



